服务热线
177-5061-9273

龙脑;冰片;2-莰醇;borneol
分子式 C10H18O
又名冰片、2-莰醇。无色或白色半透明六方形结晶体。有d、l、dl三种旋光异构体。分子量154.25。密度1.011g/cm3。熔点208℃。沸点212-214℃。闪点150℃。不溶于水。溶于乙醇、氯仿、乙醚。具有类似樟脑的气味。
生产方法:主要采用还原法。以樟脑为原料,先溶于乙醇中,再在金属钠存在下,进行还原反应而得。
用途:醇类合成香料。主要用作薰衣草、柑桔古龙香型等香精的调合香料,较多用于爽身粉及牙膏中。也可用作合成樟脑的原料。
龙脑就是冰片,又名片脑、桔片、艾片、龙脑香、梅花冰片、羯布罗香、梅花脑、冰片脑、梅冰等,是由菊科艾纳香茎叶或樟科植物龙脑樟枝叶经水蒸汽蒸馏并重结晶而得。亦有用松节油经一系列化学方法工艺而得。其可用于闭证神昏、用于目赤肿痛,喉痹口疮、用于疮疡肿痛,溃后不敛等。天然冰片(右旋龙脑)就是利用其鲜枝叶为原料,采用先进的提取工艺精制而成的纯天然制品。历史上,我国从婆罗洲及苏门答腊等地获得天然冰片,故以“龙脑”示其名贵。

龙脑樟树(Cinnamomum camphora)既是名贵稀有的药材,又是高级香料,还是重要的化工原料,有植物黄金的美誉。原产于印尼苏门答腊岛的天然龙脑香树树根曾经是龙脑的主要来源,但是由于长期过度采伐已近枯竭。龙脑最早记载于南北朝,距今已有两千多年历史,在中医典籍中龙脑被称为天然冰片,因极具透皮功能,被归于芳香开窍类药材。《本草经疏》云:龙脑“其香为百药之冠。”,我国一直未找到原生记录,长期依赖于高价进口,近代更被合成冰片所替代。1988年,在湖南新晃侗族自治县步头降苗族乡原始森林中发现的中国第一株富含龙脑的野生樟科植物-----龙脑樟。

龙脑香,又称为脑子、瑞脑、瑞龙脑等,是龙脑香科植物龙脑香树Dryobalanops aromatic Gwaertn.f.的树脂中析出的天然结晶性化合物,也是一种名贵的香药,古人称之为:“龙脑”以示其珍贵。上等龙脑香,“状似云母、色如冰雪”,质地纯净,称之为“冰片”。
龙脑香的流传
龙脑香,原产于南洋群岛各地,后随贸易往来进入中原。早在魏晋时期,中国人就认识到龙脑香祛病疗疾的功效,自《名医别录》首次出现后,就一直没有缺席本草书籍。除了药用,龙脑香还频繁用于随身佩戴、屋室熏燃、饮食配料等诸多方面,与沉香、檀香、麝香并称中国四大名香,构成了中国历史悠久又色彩斑斓的香文化。随着贸易往来进入中原地区,隋唐时期,龙脑香频繁被作为“国礼”送给中国皇帝,《隋书·卷八十二列传第四十七》记载:常骏等人奉隋炀帝之命出使赤土国(指马来西亚、印度尼西亚),赤土国王派儿子那邪迦“随并献金芙蓉冠、龙脑香”。
龙脑香的功用
魏晋时期开始,中国人就与龙脑香结下了不解之缘,龙脑香早已深深植于中国的传统文化之中,渗透在古人祛病疗疾、祝祷祈福、养神养生、日常饮食、人际交往等诸多方面,成为其不可割舍的部分。
(一)祛病
最早见于魏晋陶弘景《名医别录》记载:“味辛、苦,微寒,一云温、平、无毒。”主治心腹邪气,风湿积聚,耳肤翳。作为医籍系统介绍了龙脑香性味、主治、产地等信息,也可看出魏晋时期人们就熟悉掌握了龙脑香的药性主治等,将龙脑香作为药物使用。明▪李时珍《本草纲目》对龙脑香功用主治进行了总结与归纳,龙脑香可内服可外用,内服有开窍醒神、清热解毒之效。现代药理研究证明,龙脑香有镇痛、镇静、抗炎、抗菌、抗生育(妊娠中期和晚期有显著引产作用)的作用。
(二)佩香
中国古代很早就有的风俗,外来香料进入中原以前,人们多将兰、芷、萧、柏、艾、郁、椒、桂、辛夷、茅等香草或香木做成香囊佩戴。隋唐时期,随着龙脑香大量进入中国,佩戴龙脑香成为当时风尚。唐朝皇帝将其赏给后宫、重臣,《酉阳杂俎》记载的玄宗思贵妃的故事正是以龙脑香为线索。
(三)熏燃
宗教有焚香传统,人们相信,在氤氲香气中祷告冥想更为灵验。无论佛教,还是道教,仪式上均可见龙脑香的身影。佛教里,龙脑既是礼佛的上等供品,也是“浴佛”的主要香料之一,还被列入密宗的“五香”(沉香、檀香、丁香、郁金香、龙脑香)。在盛产龙脑的地区,龙脑树的树膏也被用作佛灯的灯油。《新五代史》记载了道教做法时焚龙脑数斤:“守元教昶起三清台三层,以黄金数千斤铸宝皇及元始天尊、太上老君像,日焚龙脑、薰陆(乳香)诸香数斤,作乐于台下,昼夜声不辍,云如此可求大还丹。”
龙脑香的今天
近代以后,香文化断层,作为香料的龙脑香逐渐淡出人民的视野,但作为药用却是刚需,因为中药的内服外用处方中,出现“冰片”的概率太高了,试举几个耳熟能详的中药复方或中成药:复方丹参片(滴丸)、速效救心丸、麝香保心丸、安营牛黄丸、牛黄解毒片、冰硼散、七厘散、生肌散、冠心苏合丸、苏合香丸、行军散、双料喉风散…… 这些药中,有上千上万元一粒者,也有3-5元一瓶的,足见冰片的使用之广。
为什么会这样?笔者觉得它的小分子高度亲脂性这个特性起到了重要的作用:其一、它是古代较易得的一种有抗菌作用的透皮剂,可打开皮肤角质层,帮助其它药物进行皮层以内,因此很多外用药散离不开它,其二,同样由于它的高度亲脂性,它是一种有效的可以透过血脑屏障的药物,而且可协助其它药物透过血脑屏障,故而不少心脑血管药物也少不了它(也许,龙脑香的脑字就这么来的)。
冰片的种类及发展
现在的冰片,有很复杂的来源,成了一个不小的家族:
合成冰片:以松节油、樟脑为原料,经化学合成的方法,得到的薄片状结晶。
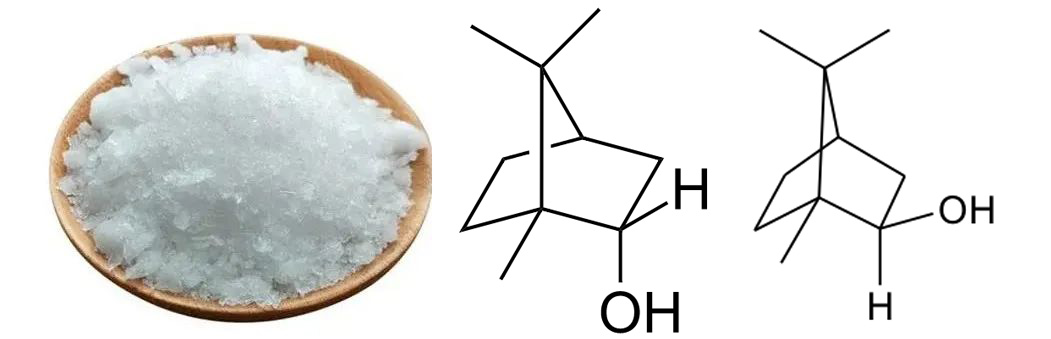
合成冰片,冰片,异冰片
艾片:从广西、云南等地发现一种菊科植物艾纳香,将它的叶子经蒸馏和反复升华,得到的结晶即是艾片。

龙脑樟冰片:从湖南、江西等地发现的数量极其稀少的樟树,其枝叶经提取、加工后可得天然冰片,以上三种来源的冰片均被收入《中国药典》一部。


龙脑香冰片:不同于龙脑樟树,它是龙脑香树分泌或提取出来的,尴尬的是,龙脑香来源的天然冰片,自2005年以后,在《中国药典》上找不到它的位置了,龙脑香来的冰片入药,在中国已无标准可依了,换句话说,它在中国,只能用作香料而不具备官方法定的药品身份。
也就是说,发展到今天,冰片有四种来源,即龙脑香树来源、艾纳香来源、合成来源、龙脑樟来源。虽然都叫冰片,外表、气味和标称的功效都基本相同,但其实它们的内在化学成分是有很大差别的。(表1),从表1可见,传统的天然龙脑香冰片,是以右旋龙脑为主的;而合成片,主要含的是消旋龙脑(约60)和消旋异龙脑,折合下来,含右旋龙脑不过30%左右,其实它应该不好意思叫冰片;而艾片主要成分是左旋龙脑,基本不含右旋龙脑;倒是精制后的龙脑樟,也是主要含有右旋龙脑(96%以上),可能是最接近传统的天然龙脑香冰片的来源了。
表1 四种不同来源冰片的比较
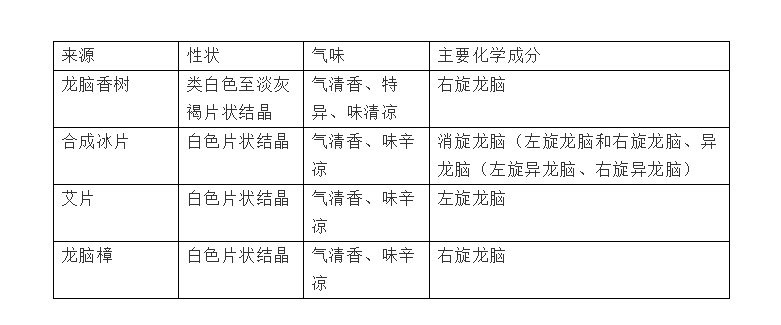
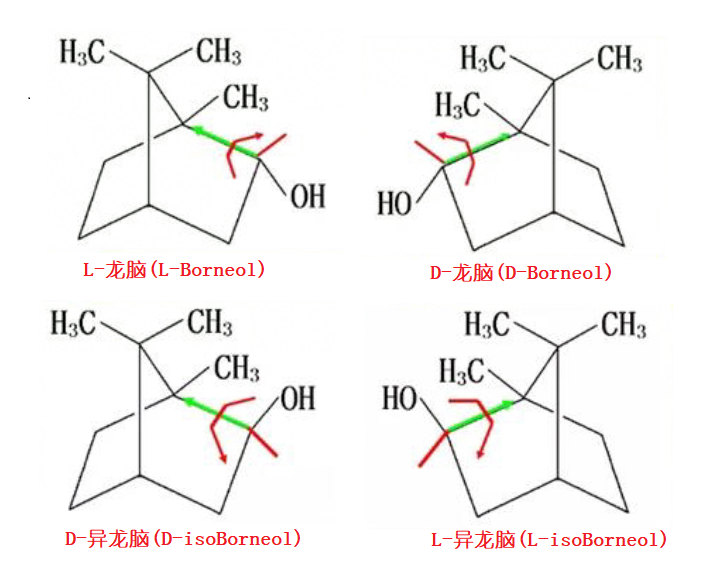
图1 冰片中含有的D-,L-龙脑以及D-,L-异龙脑成分的结构
使用禁忌
阴虚阳亢、小儿慢凉、脾虚肚泻、肝肾虚亏者、目疾者忌服冰片,孕妇慎服冰片
冰片的医用进展概述
冰片又称龙脑和梅片,外观呈无色半透明或白色六方形薄片状,质地松脆,气味芳香,有强烈清凉感。其化学名为2-莰醇,分子式C10H18O,有右旋、左旋、消旋三种旋光异构体。

按其来源分为左旋龙脑(艾片)、右旋龙脑(天然冰片)和合成龙脑。冰片在我国有着悠久的使用历史,《新修本草》记载其功效:“主心腹邪气,风湿积聚,耳聋,明目,去目赤肤翳”;《本草纲目》记载其:“通诸窍,散郁火”,一直以来,冰片素有“引药上行”和“佐使有功”的功能,因此其常作为佐使药被广泛应用。由于冰片具有促进不溶性药物透皮吸收以及可提高其他药物的血药浓度和生物利用度等作用,其在食品和医药工业应用非常广泛,是双料喉风散、复方丹参滴丸、速效救心丸、麝香保心丸、复方丹参片、心血宁片等60多种名优中成药的主要成分,起着“药引”的作用,以增加其他药物的治疗效果。
同名为冰片,差异各不同
左旋龙脑(艾片)为菊科植物艾纳香的新鲜叶经提取加工制成的结晶。右旋龙脑(天然冰片)为樟科植物龙脑樟的新鲜枝、叶经提取加工制成。合成龙脑又称异冰片,则是利用松节油中的α-蒎烯与脱水草酸为原料经过化学方法合成而得,其含左旋龙脑、右旋龙脑以及樟脑成分,因此,合成龙脑是消旋体。这三种冰片是旋光异构体,由于其结构中甲基以及羟基官能团位置的差异导致各自的生物学活性有所区别,同时,由于其来源不同,所含杂质、副产物也有所差别。
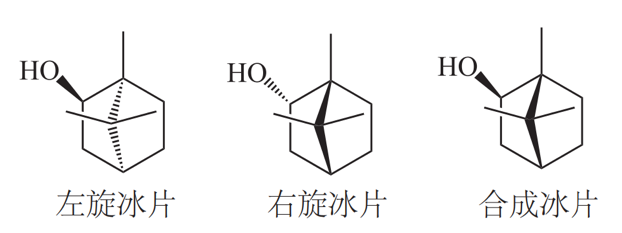
质量差异:根据药典,天然冰片应含右旋龙脑96%以上,不得检出异龙脑(异莰醇),可含有3%以下的樟脑;艾片应含左旋龙脑85%以上,可含5%以下的异龙脑和10%以下的樟脑;而合成冰片中消旋龙脑含量仅为55%以上,要求樟脑含量在0.5%以下,为限定异龙脑的含量,往往实际含44%以上的异龙脑。
活性差异:以蛙皮为体外模型,考察了天然冰片和合成冰片对栀子提取物黏膜通透性的影响。结果发现,虽然天然冰片和合成冰片均能够促进栀子提取物的渗透,但是天然冰片对其具有更好的保护效果,同时随着天然冰片比例的增加,栀子提取物的黏膜通透性增强,其对栀子苷稳定性的保护作用也增强,而合成冰片无此功效。天然冰片(右旋)和艾片(左旋)间也存在纯度和手性的差别。左旋体的药物在进入人体后的效用往往明显优于右旋体,而在体外实验中,艾片针对金黄色葡萄球菌、溶血性链球菌、肺炎球菌、白喉杆菌、绿脓杆菌等的抑菌效价也都高于天然冰片。药典中天然冰片和艾片的功能与主治完全相同,而前者常用量为0.3-0.9g,后者为0.15-0.3g,可以看出左旋冰片前景广阔,有相当的发展空间。
冰片在抗菌、抗炎、镇痛方面的应用
冰片对多种常见病菌(如大肠埃希菌、乙型溶血性链球菌、金黄色葡萄球菌、真菌等)具有高浓度可杀菌、低浓度可抑菌的功效。冰片抗炎效果显著,研究显示口服天然冰片能明显抑制巴豆油引起的小鼠耳肿胀及醋酸引起的小鼠腹腔毛细血管通透性增加。在脑缺血再灌注的大鼠模型中研究发现,冰片是通过降低包括细胞间黏附分子-1、肿瘤坏死因子-α、白细胞介素-1β、诱导型一氧化氮合酶、环氧化酶-2等炎症相关细胞因子的表达而实现抗炎的过程。使用大鼠后肢穿透伤疼痛模型,发现冰片外用于损伤部位可显著提高大鼠的继发机械痛阈、继发热痛阈值,表示冰片可抑制损伤处伤害性感受器的信号转入,对外伤性急性疼痛起抑制作用。建立小鼠疼痛模型、敲除小鼠TR-PM8基因和药理学阻断系列实验,揭示了外用冰片可激活TR-PM8外周神经元,进而激活脊髓背角突触前代谢型谷氨酸受体,抑制疼痛神经信号传递,从而实现镇痛作用。
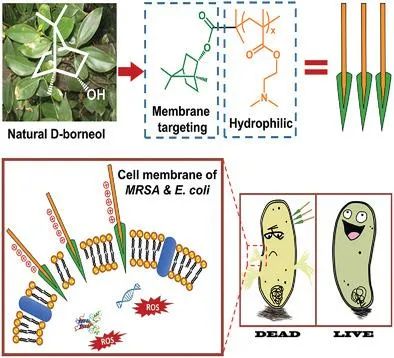
冰片是具有独特的双环单萜结构的天然提取物,由于其通过膜破坏机制的广谱抗菌特性,引起了越来越多的关注。然而,冰片的水溶性可忽略不计限制了其抗菌效率。在此,设计并合成了基于冰片的水溶性抗菌剂,以对抗具有多种耐药性的细菌。冰片与亲水性聚甲基丙烯酸N,N-二甲基乙基酯(PDMAEMA)聚合物链的整合增强了冰片对革兰氏阴性,革兰氏阳性甚至多药耐药细菌的抗菌能力。用冰片基聚合物处理后,耐甲氧西林金黄色葡萄球菌(MRSA)以50 µg mL(-1) 被完全杀死,大肠杆菌以39 µg mL(-1)被消灭。进一步证明,基于冰片的抗菌剂可以作为非浸出抗菌剂接枝到棉织物上,与涂覆有商用季铵整理剂的棉织物(AEM 5700)相比,其具有更高的持续抗菌活性。具有出色杀菌活性(尤其是针对MRSA的杀菌功能)的功能化织物在控制医院获得性感染方面可能具有巨大的潜在应用。
冰片在脑部保护作用的应用
冰片对脑缺血小鼠空间分辨学习的影响实验发现,冰片能有效减少脑缺血再灌注小鼠跳台实验中回避反应中的错误次数,延长了Y型迷宫实验中的潜伏期,缩短了逃避时间,表明冰片对缺血再灌注小鼠脑部的神经有着保护作用。研究左旋龙脑、右旋龙脑和合成龙脑3种冰片分别对永久性大脑中动脉闭塞的大鼠神经血管单元中的作用,结果表明左旋龙脑能明显改善脑缺血后24h的神经功能缺损,左旋龙脑和合成龙脑均能改善脑水肿和脑梗死面积。冰片和脑部保护药物(如栀子苷和川芎嗪等)在全脑缺血再灌注损伤模型中对神经元的协同保护作用具有区域特异性,在海马、下丘脑和纹状体区域的协同作用尤其明显。
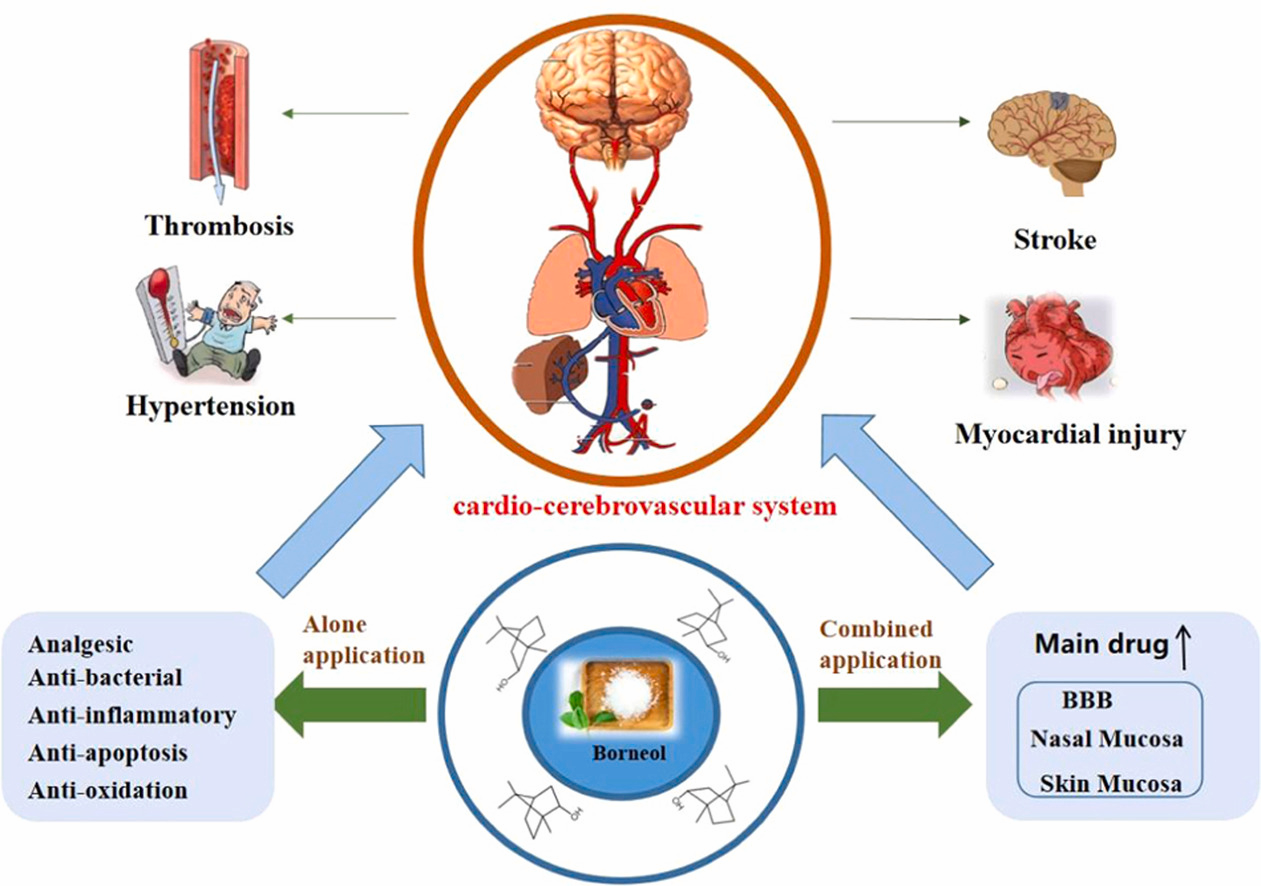
随着全球人口老龄化进程的加快,心脑血管疾病(CVDs)的发病率呈上升趋势。它已成为人类死亡的主要原因。冰片(BO)作为一种天然药物,不仅具有抗炎、抗氧化、抗凋亡、抗凝血等作用,改善能量代谢,还可以促进药物通过各种生理屏障进入靶器官或组织,如如血脑屏障(BBB)、粘膜、皮肤。因此,它对各种心血管疾病具有显著的治疗作用,这一点已在大量研究中得到证实。然而,BO对心血管疾病的药理作用和机制尚未得到充分研究。因此,本综述总结了 BO 的药理作用和可能的机制。
冰片作为药物吸收促进剂的应用
冰片在中药配伍中常用作佐药帮助其他药物更好地发挥疗效,有着“独行则势弱,佐使则有功”的说法。冰片作为芳香开窍中药代表,有脂溶性强、相对分子质量小、容易挥发、可改变脂质分子的排列和增加其流动性等特点,因而在药物的透皮吸收方面应用广泛。冰片可以促进5-氟尿嘧啶、安替比林、阿司匹林、水杨酸和布洛芬等5种模型药物的体外经皮渗透吸收,其分子机制可能与冰片通过干扰角质层脂链的结构,引起皮肤渗透屏障的改变相关。血脑屏障在阻止有害物质由血液进入脑组织的同时也阻止治疗性药物通过血脑屏障,从而可削弱药物的治疗效果。冰片具有双向调节血脑屏障通透性的作用,既能增加生理性血脑屏障通透性,促使其他药物通过其而引药上行,同时也可降低已损伤脑组织的血脑屏障通透性,起到保护脑缺血再灌注后其结构的作用。
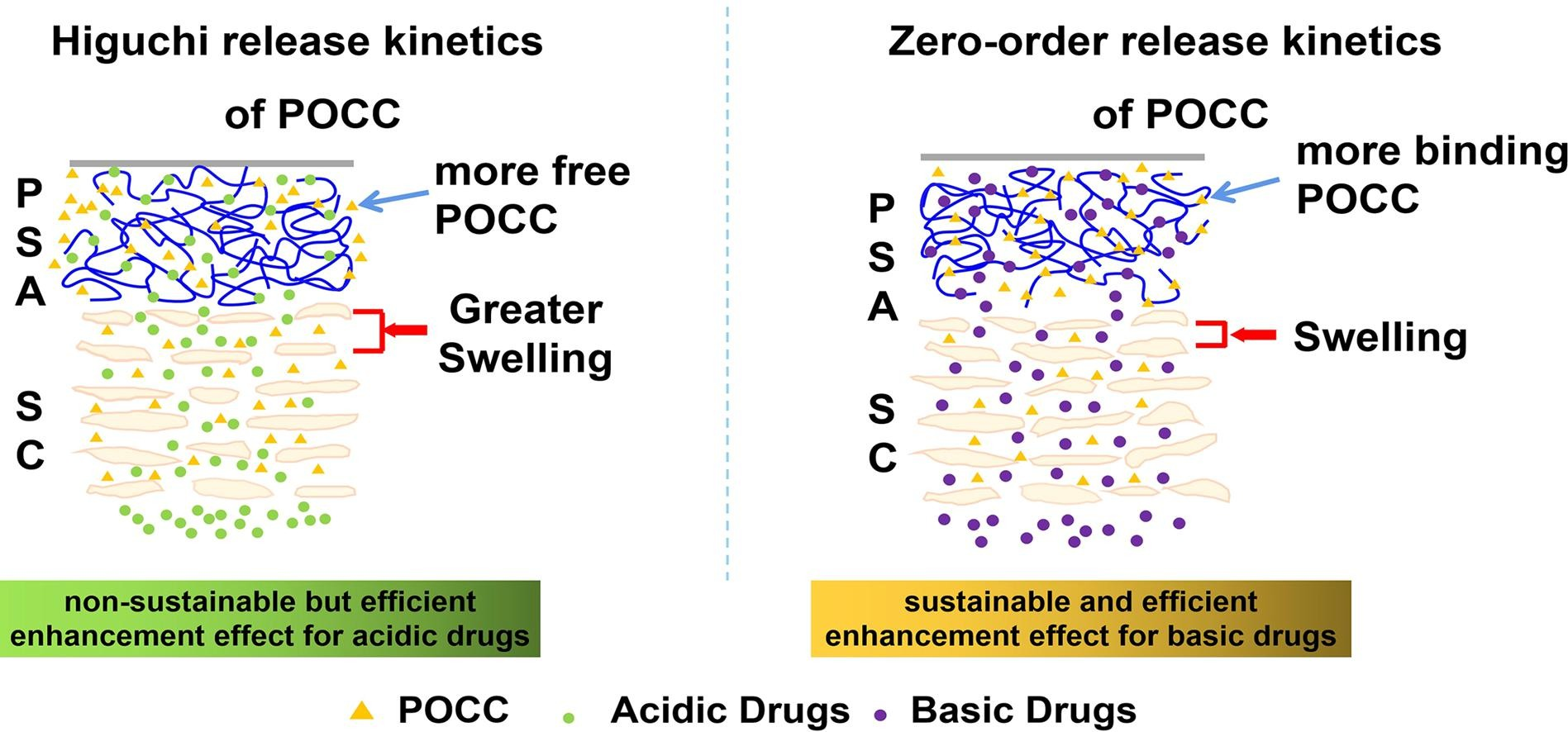
目前,渗透促进剂的释放动力学如何影响其对药物皮肤吸收的促进作用及其分子机制尚不清楚。在本文中,渗透促进剂的释放动力学(的Plurol Oleique CC(POCC)),其涉及的释放百分比(PR),释放的持续时间(RD)和释放动力学常数(ķ)和对药物皮肤吸收其增强疗效用研究体外皮肤分别进行保留研究和体外皮肤渗透研究。POCC 从酸性药物加载贴剂中释放出来,随后是 Higuchi 释放模型,并且具有短的RD(8-16 小时),导致其对酸性药物的增强效率不可持续。然而,从基本药物加载贴剂中释放的 POCC 遵循具有长RD(12-24 小时)的零级模型,从而对基本药物产生可持续且有效的增强效率。创新参数渗透增强系数(C PE)的较低方差代表相对可持续和有效的增强效果,如下所示:0.20(扎托洛芬(ZPF)),0.31(双氯芬酸(DCF)),0.27(吲哚美辛(IMC) )、0.07 (阿扎司琼 (AST))、0.11 (奥昔布宁 (OBN)) 和 0.06 (多奈哌齐 (DNP))。根据 FT-IR、MTDSC、13C NMR光谱、分子动力学模拟、SAXS和拉曼成像,Higuchi释放模型是由酸性药物和压敏粘合剂(PSA)之间的强相互作用引起的。这种强相互作用导致 POCC 从酸性药物加载贴片中扩散速度更快,并使角质层 (SC) 脂质的长周期相 (LPP) 膨胀程度提前达到平台。零级释放模型是因为碱性药物与PSA之间的弱相互作用使得大部分POCC仍然与PSA结合,这反过来导致LPP以缓慢但可持续的过程膨胀。综上所述,POCC 的零级释放动力学导致对碱性药物的持续有效的渗透增强效率,而 Higuchi 释放动力学对酸性药物显示出相反的效果。
冰片作为化疗增敏剂的应用
冰片作为一种吸收促进剂,可通过抑制多药耐药蛋白的过度表达,单独或与其他佐剂合用,增强肿瘤细胞对化疗药物的敏感性。冰片联合长春新碱能够显著提高长春新碱的抗肿瘤活性,冰片在增敏过程中的作用机制可能与其显著抑制P-gp活性有关。冰片联合顺铂能够显著增加顺铂抑制大鼠C6脑胶质瘤生长能力,其作用机制可能与冰片通过促进顺铂透过血脑屏障后累积,从而在胶质瘤部位发挥作用有关。
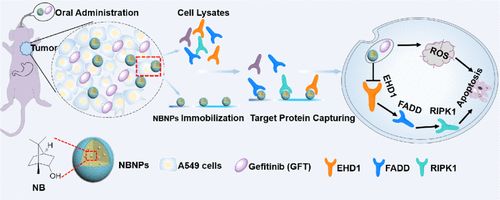
尽管有效靶向了表皮生长因子受体(EGFR),但由于在肿瘤区域的药物蓄积不足,因此将吉非替尼(GFT)用于非小细胞肺癌(NSCLC)治疗仍然失败。因此,迫切需要开发具有协同治疗作用的GFT化学增敏剂,以用于晚期癌症治疗。在本文中,将天然化学增敏剂天然冰片(NB)配制成水包油纳米乳液,以增强其溶解度,分布并最终提高GFT的治疗指数。通过蛋白质组学研究揭示,通过选择性鉴定A549 NSCLC细胞中的八个特定蛋白质靶标,NB(NBNPs)的纳米化显示出比NB更强的靶向递送和细胞毒性。NBNP通过有效调节EGFR / EHD1介导的A549 NSCLC细胞凋亡,实现了比GFT NB更强的化学增敏作用。由于NBNP和GFT之间令人满意的协同作用,因此联合疗法不仅增强了GFT对NSCLC增殖的抗癌能力,而且避免了体内的严重双重毒性。这一发现证明了NBNPs与GFT之间的有效协同作用,并进行了明确的机理研究,并有望扩展NBNPs作为晚期癌症化疗的新型化学增敏剂的应用。该联合疗法不仅增强了GFT对NSCLC增殖的抗癌能力,而且避免了体内严重的双重毒性。这一发现证明了NBNPs与GFT之间的有效协同作用,并进行了明确的机理研究,并有望扩展NBNPs作为晚期癌症化疗的新型化学增敏剂的应用。该联合疗法不仅增强了GFT对NSCLC增殖的抗癌能力,而且避免了体内严重的双重毒性。这一发现证明了NBNPs和GFT之间有效的协同作用,并进行了明确的机理研究,并有望扩展NBNPs作为晚期癌症化疗的新型化学增敏剂的应用。
冰片促进纳米药物吸收与传递
冰片具有促进不溶性药物透皮吸收以及可提高其他药物的血药浓度和生物利用度等作用。经过冰片修饰或将冰片做成复合纳米体系后,纳米药物的细胞和组织穿透能力得到增强,药效学活性也有所提高。因此,基于冰片强大的促透能力,在纳米药物中引入冰片,这将有望提高纳米药物的跨膜吸收及向肿瘤组织的递送量。有研究在神经毒素纳米体系中通过物理方法混合了冰片-薄荷脑共熔物,证实了此吸收促进剂能明显地促进药物跨过血脑屏障,提高药物在脑部的积累含量。通过对比冰片修饰和非冰片修饰的昔洛韦固体脂质纳米粒在小鼠脑部的分布情况发现,冰片通过微乳液法混合修饰的纳米系统更能增加昔洛韦向脑部的递送。
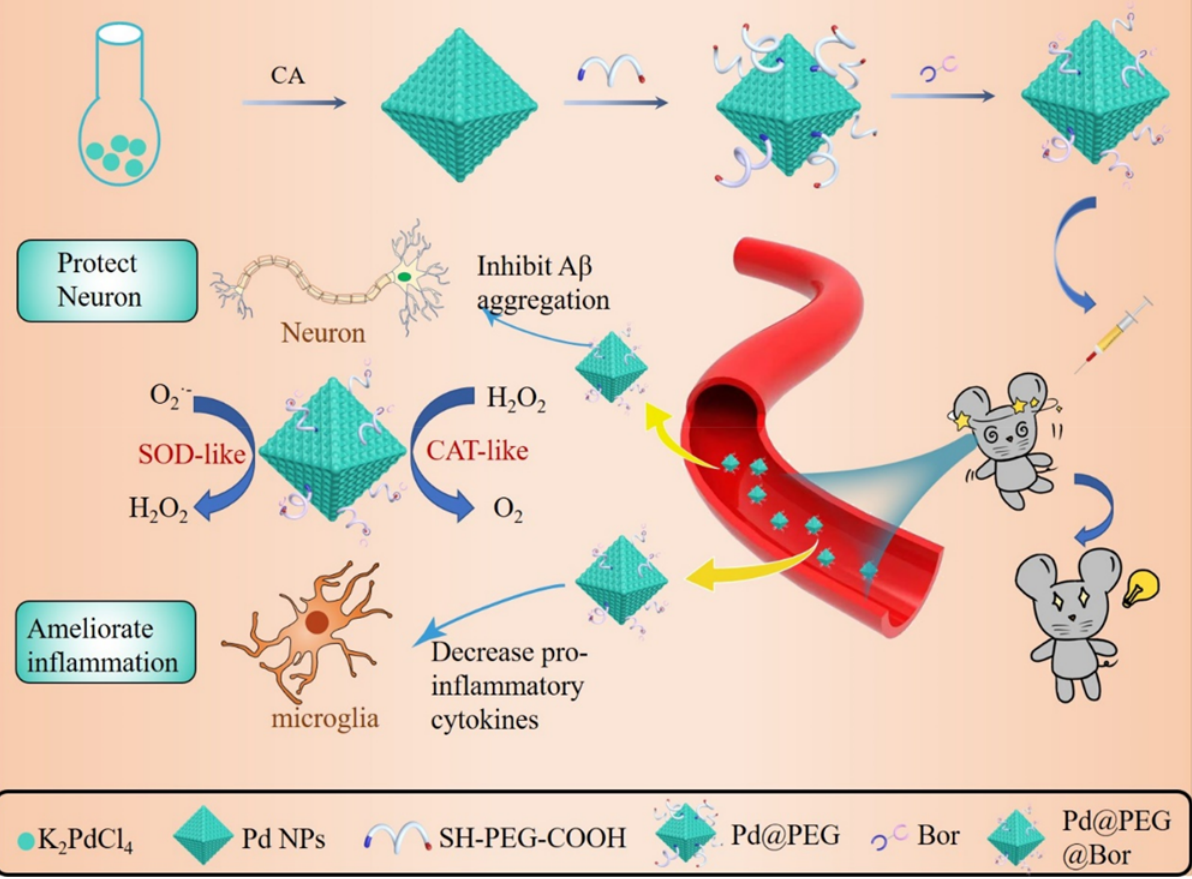
2021年10月,来自暨南大学的研究团队在《ACS APPLIED MATERIALS&INTERFACES》发表了论文“A Functionalized Octahedral Palladium Nanozyme as a Radical Scavenger forAmeliorating Alzheimer’s Disease”。在这项研究中,研究者们设计并制备了八面体钯(Pd)纳米酶复合材料(Pd@PEG@ Bor),将中药成分冰片(Bor)偶联在Pd@PEG纳米材料的表面用于提高穿过血脑屏障和靶向神经元的效率。
研究者们分别从抗氧化、生物相容性、消除ROS、血脑屏障透过实验、小鼠行为学等方面表征了复合材料的生物学性能,证明了这种复合材料能提高穿过血脑屏障的效率以及靶向神经元,消除细胞内过多的ROS,维持线粒体膜电位和钙离子水平,抑制Aβ的产生和聚集,减少神经炎症,保护神经元,并进一步改善AD小鼠的认知障碍,可以有效缓解AD的症状。
冰片是我国传统中药,具有提神醒脑、芳香开窍等作用,对小脑血管疾病以及外用治疗烧烫伤都具有显著的积极作用。现代药理学研究表明,冰片不仅具有抗菌、抗炎、镇痛等直接治疗作用,还能够促进药物透皮吸收,双向调节血脑屏障通透性,增强药物活性,从而提高药物的治疗效果。随着研究的深入,冰片在癌症化疗增敏剂方面也表现出巨大的潜在应用价值。通过对冰片进行纳米化剂型改造,或用冰片修饰纳米转运系统增强药物作用效果,这为冰片作为化疗增敏剂的开发及其他药物领域应用方面提供了新策略。
参考文献:
Liu Yang,Chengdong Zhan,Xiangyue Huang,Liangzhi Hong,Liming Fang,Wen Wang,Jianyu Su. Durable Antibacterial Cotton Fabrics Based on Natural Borneol-Derived Anti-MRSA Agents. Advanced Healthcare Materials. 2020, 9, 11, 2000186.
Songyu Liu, Yu Long, Shuang Yu, Dingkun Zhang, Qiyue Yang, Zhimin Ci, Mingquan Cui, Yulu Zhang, Jinyan Wan, Dan Li, Ai Shi, Nan Li, Ming Yang, Junzhi Lin. Borneol in cardio-cerebrovascular diseases: Pharmacological actions, mechanisms, and therapeutics. Pharmacological Research. 2021, 169, 105627.
Jiuheng Ruan, Chao Liu, Haoyuan Song, Ting Zhong, Peng Quan, Liang Fang.Sustainable and efficient skin absorption behaviour of transdermal drug: The effect of the release kinetics of permeation enhancer. International Journal of Pharmaceutics . 2022, 612, 121377.
Riming Yuan,Yanyu Huang,Leung Chan,Dihao He,Tianfeng Chen.
Engineering EHD1-Targeted Natural Borneol Nanoemulsion Potentiates Therapeutic Efficacy of Gefitinib against Nonsmall Lung Cancer. ACS Appl. Mater. Interfaces . 2020, 12, 41, 45714–45727.
Zhi Jia, Xiaoyu Yuan, Ji-an Wei, Xian Guo, Youcong Gong, Jin Li, Hui Zhou, Li Zhang*, and Jie Liu*. A Functionalized Octahedral Palladium Nanozyme as a Radical Scavenger for Ameliorating Alzheimer’s Disease. ACS Appl. Mater. Interfaces . 2021, 13, 42, 49602–49613