服务热线
177-5061-9273


一、背景及概述
龙涎香是抹香鲸(Physeter macrocephalus)的肠道产生的一种强烈的气味物质。它的作用是保护肠道粘膜不受抹香鲸所吃的软体动物的不可消化的残骸的影响,使其周围变硬并融入其中。
龙涎香一词源于古法语 "ambre gris",意思是 "灰色的琥珀",与 "黄色的琥珀 "相反,后者指的是树脂琥珀。它被用于制作香水。
在化学上,龙涎香主要由蜡质的、不饱和的、高分子量的醇类混合物组成,主要的化学成分是降龙涎醚。其他化学成分,如表皮甾醇和共轭甾醇,也被发现,但降龙涎醚是使龙涎香具有典型气味的物质。典型的龙涎香气味的形成机制见图1。[1]
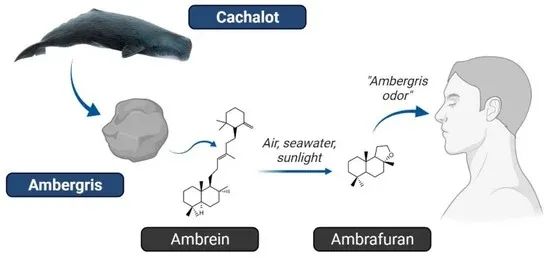
图1 典型的龙涎香气味的形成机制:由于海水、空气和/或阳光的氧化分解,从龙涎香中产生了降龙涎醚[1]
由于抹香鲸是受保护的物种,不能被猎杀,所以龙涎香现在已经变得极为罕见,被合成物质所取代。更为罕见的是,如果从被搁浅的动物尸体上取下,就有可能使用天然的,或者有时是渔民从动物反刍的龙涎香中捞出的。
降龙涎醚又名双环二氢高金合欢醚、1,1,6,10-四甲基-5,6-环乙氧基十氢化萘、Amberoxan、Ambropur、Ambroxide。天然龙涎香是一种高级香料,它来自抹香鲸肠胃中的灰白色软结石,量极少。降龙涎香醚是一种人工合成的、具有龙涎香味的香料,作为天然龙涎香的代用品。无色至白色结晶。相对分子质量236.39。熔点75~76℃。沸点120℃(1.33×102Pa)。闪点161℃。比旋光度-29°(c=1,甲苯)。降龙涎醚的分子结构如图2所示。
Ambrox 由 ambrein(龙涎香的主要成分,一种来自抹香鲸消化道的蜡状物质)与大气中的氧气反应形成。作为 (半日花烷(labdane)) 二萜的分解产物,少量降龙涎香醚也可以在以下来源中找到:烟草 (Nicotiana tabacum) (来自顺式-冷杉醇 (Z)-abienol)、快乐鼠尾草 (Salvia sclarea) (来自香紫苏醇,sclareol)、岩蔷薇 ( Cistus ladanifer 和 Cistus creticus)(来自半日花烷酸labdanolic acid),在垂枝柏(Cupressus sempervirens)和蜡质抹香鲸类尸体的脂肪体(来自ambrein)中。
Ambrein 不再用于获得 Ambrox,取而代之的是来自快乐鼠尾草(Salvia sclarea)的香紫苏醇作为起始材料。随着芬美意在 1950 年发表了第一个部分合成,发现了一种替代的降龙涎醚来源。技术合成的关键步骤是用三氧化铬CrO3对侧链进行氧化降解。随后用氢化铝锂还原内酯得到二醇,在酸存在下,二醇环化成所需的醚。热力学上更稳定的 9b-epi-ambrox 可以作为副产物形成。该反应可以工业规模进行,收率54%,1980年代初专利到期后,其他技术上可行的合成路线相继发表。使用高碘酸钠(而不是高锰酸钾)的紫苏醇降解反应发表在 Derek HR Barton 爵士的工作组中,并且正在申请专利。虽然合成步骤可以相对容易和安全地进行,但这些合成的主要缺点是供应情况波动,因此紫苏醇的价格波动很大。作为紫苏醇的替代品,也可以使用 (+)-cis-abienol生产降龙涎醚。(+)-cis-Abienol 获自 Canada balsam。通过 (+)-cis-abienol 的臭氧分解和随后的还原后处理,获得了一种二醇,该二醇可以在吡啶中用甲苯磺酰氯以优异的收率环化为 Ambrox。
Ambrox是一种自古以来就广为人知的香水,用于香水。Ambrox 的不同立体异构体具有相似的气味,但气味阈值不同。降龙涎醚和类似物的世界年产量刚刚超过 30 吨。
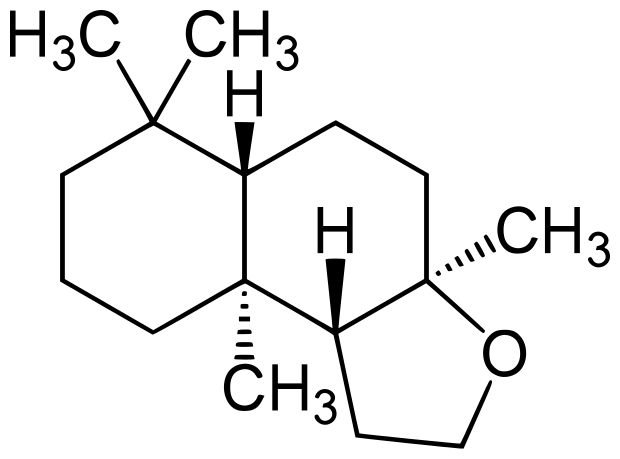
图2 降龙涎醚的分子结构
二、降龙涎醚及其异构体的香气特征及其使用法规
降龙涎醚[(-)-Ambrox]是天然龙涎香酊最关键的有效成分之一,具有柔和、持久、稳定的动物型龙涎香香气、温和的木香香韵。降龙涎醚具有多个不同的立体异构体结构,异构体之间具有一定的香气特征差异,如图3所示。降龙涎醚异构体a具有温和的木香香韵、较粗的马铃薯-地窖的味道,香气强度比降龙涎醚低100倍;异构体c具有与降龙涎醚相当的香气强度,但有微弱的丰富而复杂的酒香味;异构体e和g有弱的樟脑木香香气,带有几乎很难辨别的龙涎香香气;异构体f具有微弱的类似龙涎香香气,但被一种汗臭味掩盖;异构体h木香香气更强,但缺乏温暖的动物气息。降龙涎醚不同的香气特征差异,同样化学结构的化合物所选用的生产原料不同也会造成不同的香气差异,如溶剂能对最终产品的香气产生轻微的改变,结晶方式的不同也会造成不同的香气差异。[1]
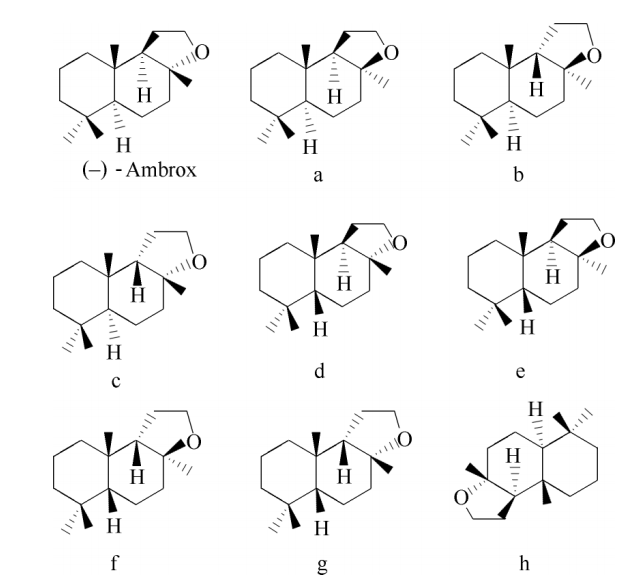
图3 降龙涎醚及其8种异构体[2]
合成的降龙涎醚[(-)-Ambrox]是极其优秀的定香剂,是所有合成龙涎香香料中评价最高的一种,是天然龙涎香优异代用品之一。由于降龙涎醚对人体无刺激、无过敏反应,因此很适合用于皮肤、头发和织物的加香,在化妆品行业中被广泛应用。降龙涎醚在食品工业中作为食品添加剂也被允许使用,被列入我国食品添加剂使用标准(GB2760—2011)允许使用的食品合成香料名单中(编号为S0280),也被美国食品香料和萃取物制造者协会(FEMA)认可为安全食用香料(FEMA编码为3471),联合国粮农组织和世界卫生组织下的食品添加剂联合专家委员会(JECFA)也认可了其食用安全性(JECFA 编码为1240)。[2]
三、降龙涎醚的制备方法进展
1、几种工业生产方法
目前降龙涎醚的工业生产方法主要是以香紫苏醇为原料的合成路线及国际著名香料公司瑞士芬美意开发的以 β-二氢紫罗兰酮 或金合欢醇类似物为原料的合成路线,具体合成路线如图4 所示。以 β-二氢紫罗兰酮(β-dihydroionone)为原料的合成路线通过 Darzens 反应、Knoevenagel 反应、脱羧、环化、还原、环化共 6 步反应合成消旋体降龙涎醚,如需制备光学纯降龙涎醚,需通过对中间体香紫苏内酯(sclareolide) 进行手性拆分;金合欢醇类似物(homofarnesol)可通过环化反应直接得到消旋体降龙涎醚。这两条反应路线主要用于制备其外消旋商品 Cetalox 和 Ambrox DL。以香紫苏醇为原料的合成路线通过氧化、还原、环化 3 步反应可得到光学纯降龙涎醚,是目前生产降龙涎醚最重要的方法。
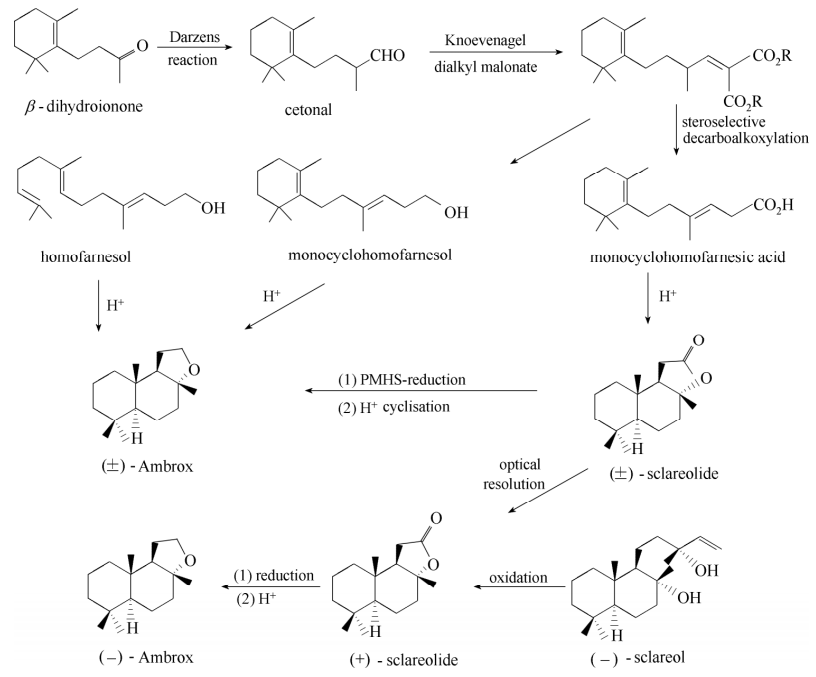
图4 降龙涎醚的工业制备路线 [2]
2、一些实验室研发阶段的合成方法
降龙涎醚的合成方法主要以多烯类化合物为原料,经催化多级串联环化的方法制备降龙涎醚。1950 年,Stoll 等以从香紫苏(Salvia sclarea L.)的茎叶中提取得到的香紫苏醇(sclareol)为原料首次化学合成降龙涎醚。随后,化学家们以众多的天然萜类化合物,如 甲基半日花烷(methyl communic)、甲基萘甲醇(drimenol)、松香酸(abietic acid)、香叶基丙酮(geranylacetone)、香芹酮(carvone)、齐墩果酸 (oleanolic acid)、金合欢醇类似物(homofarnesol)、二氢紫罗兰酮(dihydroionone)、冷杉醇(abienol)、稠环烯酮(fused ring enone)、泪杉醇(manool)等为原料成功地合成了降龙涎醚,各种天然萜类化合物具体结构如图5 所示。其中具有代表性的合成方法主要包括以下研究工作。
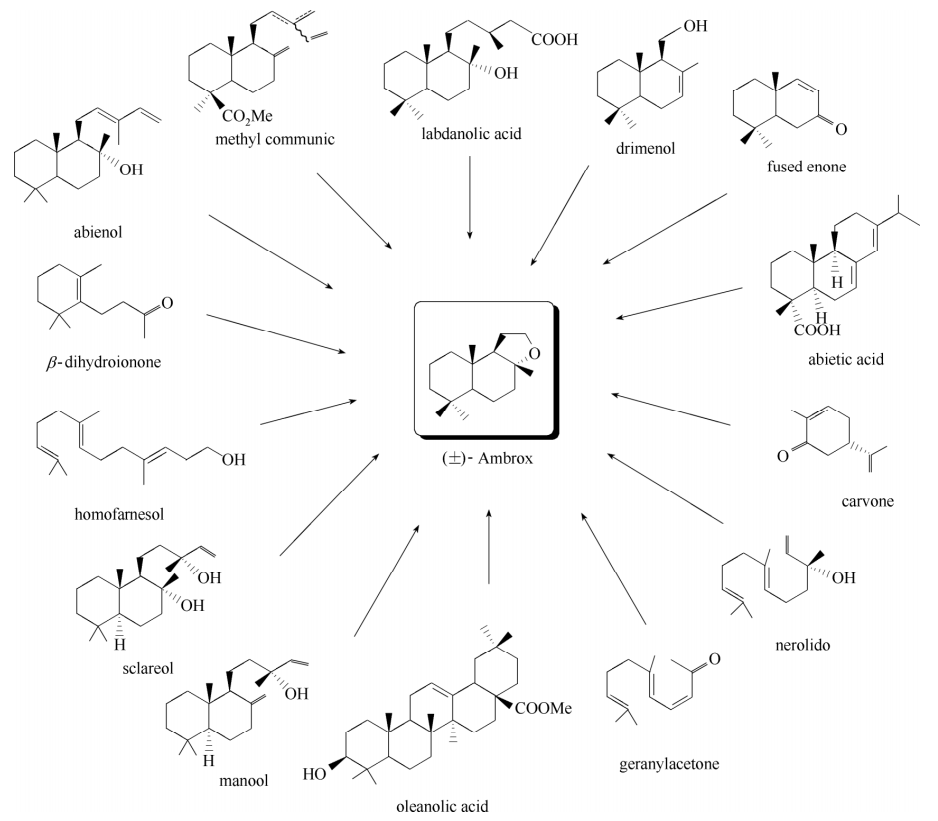
图5 合成降龙涎醚的多烯类化合物 [2]
3、降龙涎醚相关二萜类香气化合物的酶法合成生物学
尽管植物来源的半日花烷二萜类化合物作为半合成(-)-降龙涎醚的起始材料具有普遍的效用,但有几个因素限制了它们的工业应用。许多天然二萜类化合物在植物体中只少量存在,而且往往是复杂混合物的一部分,因此在化学合成中的应用需要费力和成本高昂的纯化程序。此外,获得生产二萜类的野生植物物种可能是有限的,而且植物的栽培可能受到不利环境条件的影响。因此,二萜类化合物生产基因和酶的发现和工程提供了一个机会,以改善和扩大用于制造降龙涎醚的起始材料的可用性。先进的高通量代谢物分析和转录组测序使人们能够对许多以前无法进行全面基因发现的二萜类植物物种进行快速和具有成本效益的调查。近年来,许多二萜合成酶(diTPSs)和细胞色素P450单加氧酶(P450s)的鉴定和明确的功能注释,这是二萜类生物合成的两个关键酶类。[3]
一般来说,萜类化合物有一个共同的生物合成来源,即来自两个C5中间物,二磷酸异戊酯(IPP)和二磷酸二甲酰(DMAPP)。通过异戊二烯基转移酶的活动使这些构件缩合,产生一些具有不同链长的异戊二烯基二磷酸酯中间物,作为所有萜类化合物的核心前体。二萜类化合物来自于C20中间体双牻儿基焦磷酸盐(GGPP),它被diTPSs通过多步骤的碳原子驱动的(环)异构化反应转化为各种线性或环状支架。通过P450s和其他一些酶类的活动,对diTPS产品进行功能改性,从而使植物二萜类化合物具有巨大的化学多样性。[3]
diTPS功能的多样性部分是基于其模块化结构,该结构由三个α螺旋结构域α、β和γ的变化组成。三个主要的diTPS类别是单功能的I类diTPS、单功能的II类diTPS和双功能的I/II类diTPS。这三类具有不同的结构域,并在活性位点的数量和特征功能图案方面有所不同。II类diTPSs在β-γ结构域中有一个N端活性位点,伴随着一个共同的DxDD结构域,有利于质子化引发的GGPP环异构化为各种具有不同立体化学和区域特异性氧合的双环戊烯基二磷酸酯中间体。相比之下,I类diTPSs在α-结构域中含有一个C-末端活性位点,以及用于结合底物二磷酸酯基团的催化性DDxxD和NSE/DTE结构域。I类diTPSs促进GGPP的转化或II类diTPS产物的转化。I类diTPSs催化电离促进的底物二磷酸酯基团的裂解,以及随后产生的碳化物的重新排列,产生多种二萜结构。双功能I/II类diTPSs在一个蛋白质中同时含有II类和I类活性位点和功能。据目前所知,只有苔藓、苔藓植物江南卷柏(Selaginella moellendorffii)和裸子植物含有双功能的I/II类diTPSs。[3]
在被子植物中,大多数二萜类化合物,包括所有与半日花烷有关的化合物,是通过一对单功能的II类和I类diTPSs的顺序活动形成的。反复的基因复制,随后的亚功能化和新功能化导致了diTPS基因家族在进化过程中的扩展和功能分化。最近对一些物种的研究表明,二萜类生物合成可能以模块系统的形式组织起来,其中I类和II类酶的不同组合可以产生不同的二萜类支架,进一步增加二萜类中间产物和产品的化学空间结构的多样性。[3]
从植物体中成对作用的功能不同的diTPSs的自然发生的模块途径的特征中收集的信息,可以应用于开发基于现有diTPSs和可能的P450酶的组合表达的代谢工程和合成生物学战略。在已建立的高价值萜类化合物代谢工程平台(如抗癌二萜药物Taxol和用于治疗疟疾的倍半萜类青蒿素)所取得的经验基础上,一些实验室目前正在开发用于生产天然和非天然二萜类生物产品的新的微生物和植物平台,如图6所示。[3]
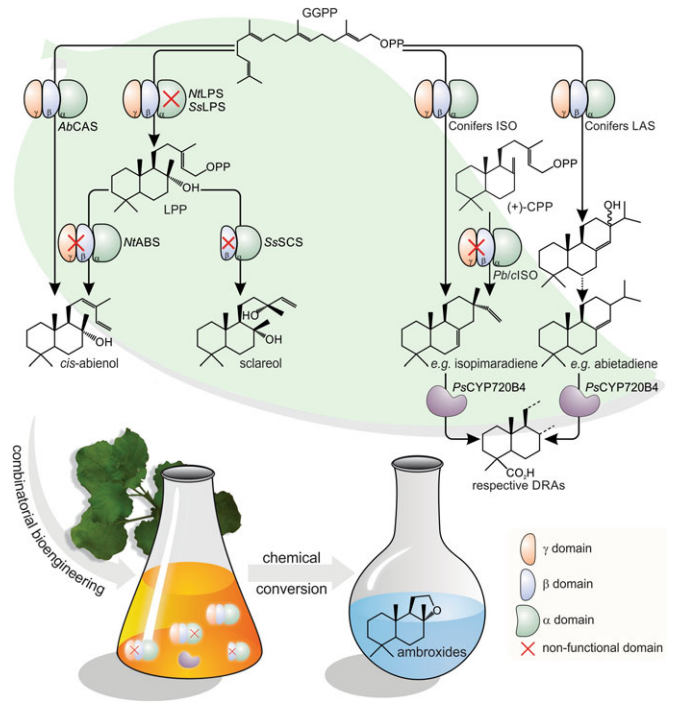
图6 植物二萜类生物合成途径的模块化及其对生物系统的代谢工程的效用,用于生产降龙涎醚前体。近年来,根据转录组测序和非模式芳香植物中的酶学特征,发现了参与形成植物源性降龙涎醚前体(如香紫苏醇、顺式冷杉醇和二萜类树脂酸)的多种二萜合成酶和细胞色素P450单加氧酶组合。二萜类生物合成酶在微生物和植物宿主系统中的单一或组合表达,为降龙涎醚前体和其他二萜类生物产品的代谢工程提供了可行性。这些工程系统能够以单一目标化合物或低复杂性混合物的形式生产天然或新型二萜类化合物。缩略语:GGPP,双牻儿基焦磷酸盐;LPP,拉巴达(labda)-13-烯-8-醇二磷酸酯;(+)-CPP,(+)-焦磷酸古巴酯;AbCAS,香柏树顺式冷杉醇醇合成酶;NtLPS,烟草拉巴达(labda)-13-烯-8-醇二磷酸酯合成酶; NtABS, 烟草顺式-冷杉醇合成酶; SsLPS, 快乐鼠尾草拉巴达(labda)-13-烯-8-醇二磷酸酯合成酶; SsSCS, 快乐鼠尾草香紫苏醇合成酶; ISO, 来自不同针叶树的异哌啶烯合成酶; LAS, 来自不同针叶树松科属/纽叶松异海松二烯的左旋哌啶/松香二烯合酶; PsCYP720B4, 大白花地榆细胞色素P450 720B4; DRA, 二萜类树脂酸。diTPS示意图中的红色X表示单功能酶中的非功能活性部位[3]
四、降龙涎醚的用途
降龙涎醚“龙涎香效应”可大大提高香精的扩散作用,用于高级香水及化妆品的香精中,对人体无刺激,适合于皮肤、头发和织物的加香,如肥皂、爽身粉、膏霜及香波等的加香及定香。
龙涎香香原料在卷烟中的应用赖百当类物质是香料烟的关键性致香成分,降龙涎醚是其中作用特别突出的一种香料,对混合型卷烟的烟气有着重要贡献。降龙涎醚也广泛用于烤烟型卷烟和香水工业。降龙涎醚应用于卷烟工业的加香加料,与烟草的特征香韵谐调和合,并可掩盖杂气,即使微量使用,也可改善烟草的香味品质,尤其适合混合型卷烟加香,增强东方型烟草的风味。R.J.Reynols Tobacco Company (雷诺烟草公司)已使用香紫苏内酯、降龙涎二醇及降龙涎醚负载于溶剂中,以万分之五到千分之三的施加量喷洒到烟丝上,以改善卷烟的风味。由于降龙涎醚分子量小、挥发性强,且阈值低。瑞士奇华顿香料公司Givavdan将降龙涎二醇制备成碳酸酯(Carbonate-I,Chart2)潜香物质,其分子量大,不易挥发。在卷烟抽吸过程中,香气前体物降龙涎二醇碳酸酯在高温分解、同时环合产生降龙涎醚香气成分,卷烟烟气具有明显的木香及琥珀香气。湖南中烟工业公司将降龙涎二醇制备成草酸酯(Oxalate-II,Chart2)潜香物质的形式,然后加入到烟草中,其加入方式为加表香、加料香或薄片加香。在卷烟抽吸燃烧过程中均匀释放降龙涎醚致香物质,使卷烟具有较明显的龙涎香气。
五、龙涎香的药理活性
1、增强食欲及性欲作用
Mohamed等(2012)研究评估了龙涎香对一些内分泌激素、血脂、体重和食欲的影响。共招募了40名受试者,随机接受415毫克/天的龙涎香(Am;n=20)或安慰剂(PL;=20),为期4周。血液样本用于评估血脂、睾酮、雌二醇、生长激素(GH)、催乳素、胰岛素、甲状腺素(T4)和皮质醇。数据显示,仅在服用龙涎香后,睾酮、雌二醇、催乳素、胰岛素、皮质醇、甲状腺素(T4)水平和体重都有明显增加,而生长激素在两组中都没有明显的变化。总胆固醇(Tc)、低密度脂蛋白胆固醇(LDLc)和高密度脂蛋白胆固醇(HDLc)明显增加,而龙涎香组的甘油三酯(TG)水平明显下降。他们的结论是,由于龙涎香对一些内分泌激素的影响,摄入龙涎香会导致性欲和体重的增加。[4]
2、抗癌作用
龙涎香对人类肝癌、结肠腺癌、肺癌和人类乳腺癌细胞系表现出细胞毒性活动。此外,龙涎香在抑制人类中性粒细胞功能方面具有抗炎活性。[5]
3、壮阳作用
龙涎香的主要成分Ambrein对雄性大鼠的性能力有支持作用。交配研究是通过将雄性与接受的雌性关在一起进行的。在观察了接受治疗的雄性大鼠的交配行为后,龙涎香形成了反复的阴茎勃起事件,一个依赖剂量的、强烈的和重复的射精上升。这项研究已被证明可以增加大鼠的性行为,这为其传统的壮阳药用途提供了一些支持。[5]
4、抗糖尿病作用
降龙涎醚通过增强葡萄糖的利用,降低了正常和中度阿洛桑处理的糖尿病大鼠的血糖水平。在有甘露糖的情况下,降龙涎醚不能降低葡萄糖负荷大鼠的高血糖,但在没有甘露糖的情况下,它能降低葡萄糖负荷大鼠的高血糖。[5]
5、其他活性
龙涎香以前被用作治疗各种疾病的传统药物。然而,由于龙涎香的主要成分天然1的生物活性(如龙涎香样品1和2中含有1,约为68%;图7d)尚未被广泛评估,因为它很稀少。到目前为止,只知道它的壮阳、抗痛和抑制弹性蛋白酶释放的活性。由于本研究中的酶法合成使合成1的生产足够充分,因此对其两种生物活性进行了分析。首先,我们分析了1对骨细胞、成骨细胞和破骨细胞的分化所产生的影响。用茜素红S对成熟的成骨细胞沉积的细胞外钙进行染色,然后用或不用10μM的1培养细胞。然而,没有发现1对成骨细胞活性的明显影响。相反,在10μM的浓度下,1增强了破骨细胞的分化(图8)。结果表明,1以浓度依赖的方式显著增加了成熟破骨细胞的数量(图8)。50μM的1的效果与5μM的Kenpaullone相似,后者是破骨细胞分化的一个强有力的激活剂。这一结果表明,1可能是治疗由破骨细胞功能缺陷引起的骨质疏松症的一个有希望的候选药物。[6]
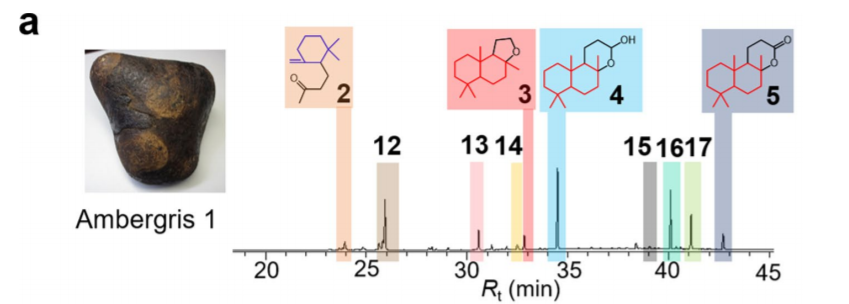
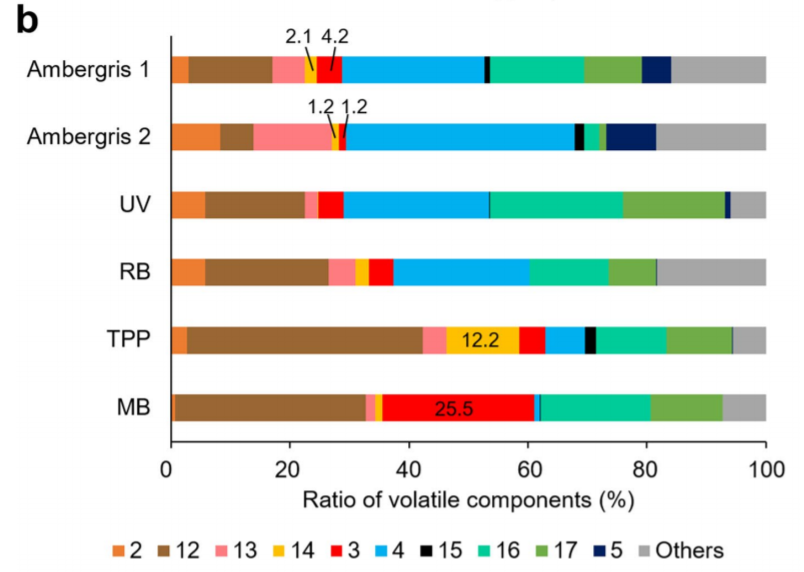
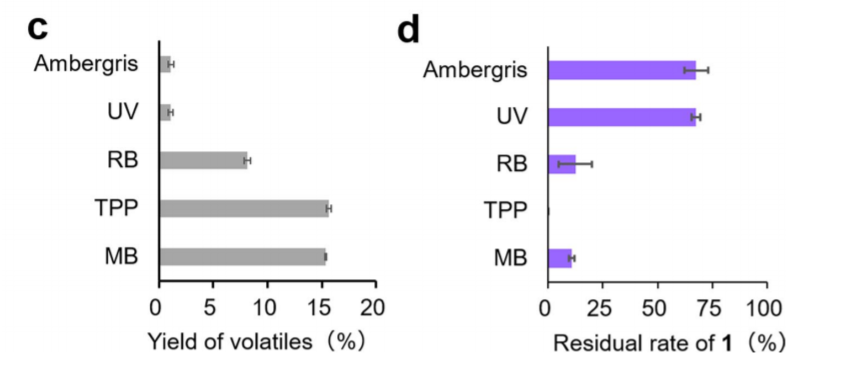
图7 1转换为挥发性成分。(a) 龙涎香挥发物的GC-MS色谱图。化合物2-5被确认,而化合物12-17没有被确认。(b) 用紫外光和光敏剂(RB、TPP或MB)处理1产生的龙涎香挥发性成分和挥发性化合物的百分比。除2-5和12-17外,"其他 "的Te比例是用化合物的总量计算的。(c) 用紫外光和光敏剂(RB、TPP或MB)处理1产生的龙涎香挥发性成分和挥发性化合物的产量。(d) 龙涎香和暴露于紫外线和光敏剂(RB、TPP或MB)的反应液中1的残留率。[6]
尽管早期关于1的光氧化的研究旨在模仿天然龙涎香的挥发性成分的产生并分离出挥发物9-11,但没有一项研究旨在实现1到挥发物的有效转化。在这项研究中,我们能够获得8-15%的产量(图7c),这比以前为不同目的获得的产量9-11和我们分析的天然龙涎香中的含量(图7c)要高。我们构建的挥发性物质合成系统可以改变气味,这取决于所使用的光敏剂的类型(图7b)。在未来,通过研究各种反应条件,包括使用不同的光敏剂,可以产生各种气味。此外,尽管在本研究中检测到了未知的挥发性化合物12-17(图7a和补充图12),但无法确定其结构。如果大量的1被光氧化,未来可能会发现新的气味化合物。此外,我们确定了1的两种生物活性:促进破骨细胞的分化和预防Aβ的神经毒性(图8和9)。然而,目前仍不清楚这种化合物是如何进行这些活动的。识别1的细胞内靶分子可能会使我们在未来发现治疗骨质疏松症和阿尔茨海默病的药物。[6]
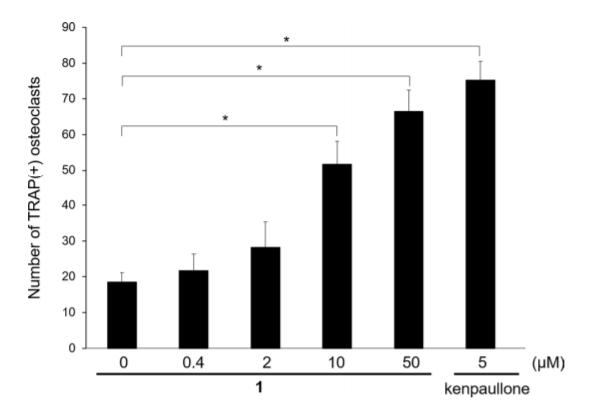
图8 1对破骨细胞分化的生物影响。在没有或有不同浓度的1的情况下,计算从RAW264.7细胞分化出来的TRAP阳性破骨细胞的数量。Kenpaullone是一个阳性对照。数据以平均值±S.D.表示(n=3,*=P<0.01)。
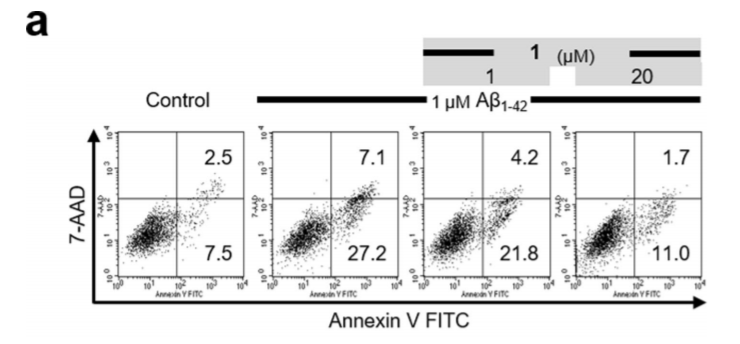
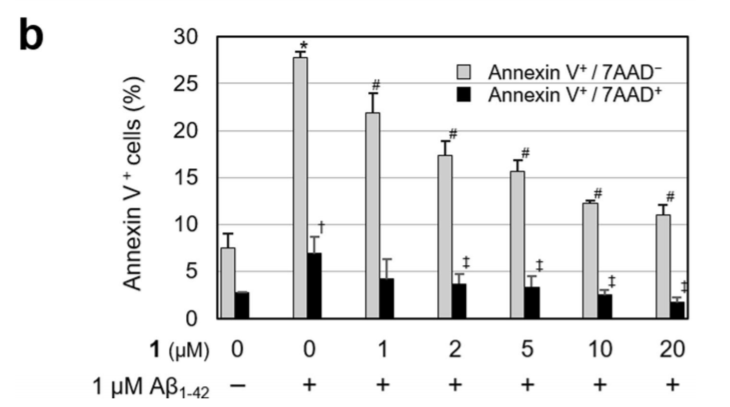
图9 1对Aβ1-42诱导的SK-N-SH细胞凋亡的保护作用。在暴露于1μM Aβ1-42 24小时之前,用不同浓度的1(1、2、5、10和20μM)对细胞进行预处理。使用Annexin V/7-AAD染色法,通过荧光细胞仪分析凋亡细胞。(a) 代表性实验的点阵图。右下角的数字表示早期凋亡细胞(Annexin V+/7-AAD-)的百分比,右上角表示后期凋亡和死亡(Annexin V+/7-AAD+)细胞的百分比。(b) 早期凋亡细胞(Annexin V+/7-AAD-)和后期凋亡和死亡细胞(Annexin V+/7-AAD+)的百分比。数据表示为平均值±SEM;(n=3)。*和†分别指Aβ1-42单独组与对照组在附件素V+/7-AAD-和附件素V+/7-AAD+细胞的比较;*或†=P<0.01。#和‡指的是1个预处理组与Aβ1-42单独组在附件素V+/7-AAD-和附件素V+/7-AAD+细胞中的比较;#或‡=P<0.01。
这项研究有别于传统的生物合成研究,后者旨在重建天然生物合成途径。这是一个挑战,因为它的生物合成途径仍不清楚,要用实验室创造的酶来合成一个罕见的天然产品(1),这是一个人工生物合成路线。许多新的自然产品已经通过基因组挖掘被发现。然而,如果生物合成酶是一种新的类型,或者如果产品的天然生产者是未知的,就不能进行基因组挖掘。因此,在未来通过人工创造新的生物合成酶来合成所需的化合物将是非常重要的。此外,本研究构建的系统可以通过重新设计酶和使用底物类似物来合成1类似物和香味类似物,并将在未来创造出具有众多气味和生物活性的化合物,超越自然界中发现的化合物。[6]
参考文献
[1]Cristiano, L.; Guagni, M. Zooceuticals and Cosmetic Ingredients Derived from Animals. Cosmetics 2022, 9, 13. https://doi.org/10.3390/cosmetics9010013
[2]杨邵祥,田红玉,刘永国,丁瑞,孙宝国. 降龙涎醚合成研究进展. 化工学报, 2018, 69(1): 88-101.
[3]Schrader, Jens; Bohlmann, Jörg (2015). [Advances in Biochemical Engineering/Biotechnology] Biotechnology of Isoprenoids Volume 148 || Enzymes for Synthetic Biology of Ambroxide-Related Diterpenoid Fragrance Compounds. , 10.1007/978-3-319-20107-8(Chapter 308), 427–447. doi:10.1007/10_2015_308
[4]Mohamed_Kotb,Kotb EI Sayed, Zakaria-y, Al-Shoaibi. Effects of ambergris on appetite and serum endocrine hormonal levels in skinny sufferers. Asian Journal of Pharmaceutical and Clinical Research, 2012, 5(3):138-142.
[5]Prashant Kumar Singh, Badruddeen*, Mohammad Irfan Khan, Mohammad Khalid and Ghazanfer. Potential Benefits of Ambergris Beyond Perfume. Journal of Complementary Medicine, 2018, 7(1): 555705.DOI: 10.19080/JCMAH.2018.07.555705.
[6] Yamabe, Y., Kawagoe, Y., Okuno, K. et al. Construction of an artificial system for ambrein biosynthesis and investigation of some biological activities of ambrein. Sci Rep 10, 19643 (2020). https://doi.org/10.1038/s41598-020-76624-y