服务热线
177-5061-9273

中文名称:金合欢醛
中文别名:3,7,11-三甲基-2,6,10-十二烷三烯醛;
英文名称:farnesal
英文别名:FARNESAL; 2,6,10-Dodecatrienal, 3,7,11-trimethyl-; 2,6,10-Farnesatrien-1-al; 3,7,11-Trimethyl-2,6,10-dodecatrienal; Einecs 242-957-9; 3,7,10-trimethyl-2,6,10-dodecatrienal; 3,7,11-trimethyl-dodeca-2,6,10-trienal; farnesyl aldehyde; 10-dodecatrienal,3,7,11-trimethyl-6; Farnesal,Pract.
PSA:17.07000
LogP:4.60450
金合欢醛物化性质
折射率 n20/D >1.4920(lit.)
闪点 147.8ºC
蒸汽压 0.000187mmHg at 25°C
密度 0.868g/cm3
沸点 328.6ºC at 760mmHg
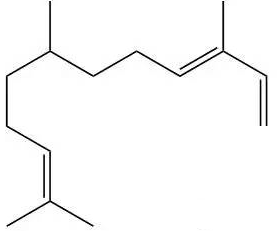
金合欢醛(法尼醛)
金合欢醛又叫法尼醛。因为α金合欢烯,也叫作法尼基。金合欢醛属于倍半萜烯醛,主要来自柠檬草和马鞭草中。金合欢醛闻起来有女人柔美的味道。金合欢醛特性有活化卵巢、增加女性魅力、提高卵子成熟率、助孕等效果。
CAS号:106-28-5
英文名称:(E,E)-Farnesol
英文同义词:FEMA2478;(E)-farnesol;InhibitorA2;(E,E)-FARNESOL;trans-Farnesol;all-E-Farnesol;(2E,6E)-Farnesol;Farnesol,(E,E)-;ALLTRANSFARNESOL;TRANS,TRANS-FARNESOL
中文名称:金合欢醇
中文同义词:金合欢醇;反反-法呢醇;金合欢香叶醇;反式-金合欢醇;丙异戊二烯基醇;全反式金合欢醇;反,反-金合欢醇;金合欢醇(法尼醇);反式,反式-金合欢醇;(E,E)-金合欢醇CBNumber:CB4669245
分子式:C15H26O
分子量:222.37
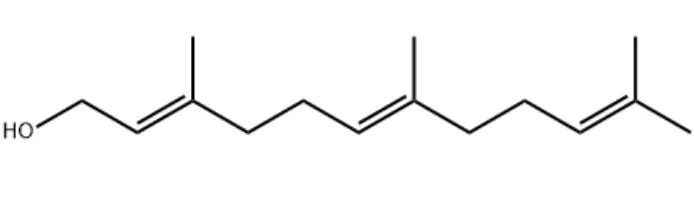
金合欢醇(法尼醇)
金合欢醇的化学性质
熔点:61-63°C
沸点:149°C 4mmHg(lit.)
密度:0.886g/mL at 20°C(lit.)
折射率:n20/D1.490(lit.)
闪点:205°F
储存条件:Sealed in dry,2-8°C
酸度系数(pKa):14.42±0.10(Predicted)
形态:neat
水溶解性:Miscible with alcohol. Immiscible with water.
敏感性:Light Sensitive
BRN:1723039
InChIKey:CRDAMVZIKSXKFV-YFVJMOTDSA-N
CAS数据库:106-28-5(CASDataBaseReference)
NIST化学物质信息:2,6,10-Dodecatrien-1-ol,3,7,11-trimethyl-,(E,E)-(106-28-5)
EPA化学物质信息:(E,E)-Farnesol(106-28-5)
化学性质
无色油状液体。沸点263℃,相对密度0.887-0.889,折射率1.489-1.491,闪点100℃以上,溶于3体积70%乙醇及许多香料和油类。有蜜甜的玫瑰、铃兰、菩提花及圆叶当归子的气息。用途
广泛用于多种香型的香精中。可用于菩提花、紫丁香、铃兰Chemicalbook、鸢尾、玫瑰、紫罗兰、刺槐、金合欢、玉兰、兔耳草花及素心兰型、东方香型、膏香型香精,能增强甜花香。也可少量用于食用香精,如杏子、香蕉、浆果、樱桃、桃子、黄瓜、草莓、悬钩子、甜瓜、圆醋栗及柑橘。
用途
用于合成萜烯类化合物,例如鲨烯类化合物、西松烯类化合物和毛喉萜。
金合欢醇在化妆品方面的应用
金合欢醇广泛存在于植物体的花、叶、茎等部位之中,尤其是在一些中草药植物和香料植物中具有较高含量,如细毛樟、辛夷花、枇杷叶等是具有较好开发利用前景的重要资源。金合欢醇是中草药植物的重要活性成分之一,也是一些重要香料植物精油中的主要香料成分之一,因此,在医药、农药、化妆品和日用化工等需要其生物活性的方面已经得到较多应用,并具有较好的前景。国内外研究报道,综述了金合欢醇的主要资源及其生物活性应用。
链状倍半萜化合物金合欢醇是重要的高级香料之一,也是重要的生物活性物质或活性物质中间体。金合欢醇也称法呢醇(farnesol),化学名称为3,7,11一三甲基-2,6,10-十二碳三烯-1-醇(3,7,11一trimethyl-2,6,10-dodecatrien-1-ol),分子式C15H26O,相对分子质量222.41。金合欢醇有4种几何异构体,分别为反反式、反顺式、顺反式和顺顺式,自然界中主要以反反式存在,但橙叶精油中则以顺反式存在。金合欢醇为无色油状液体,具有令人愉快温和而细腻的带有铃兰特征的花香气味,同时由于其具有很好的定香作用,常用做基香,是高档花香香精中的重要香原料,沸点110℃(47 Pa),149℃(532 Pa),闪点96°C,折光率1.486~1.478(25°C),相对密度0.882~0.892(20℃),不溶于水。金合欢醇的物理常数会随着来源和异构体的不同而有所变化。金合欢醇分子中有3个双键,存放时最好保持低温,同时密封要好,这样能有效减少金合欢醇的氧化。
金合欢醇的急性毒性数据,为口服LD50 20mL/kg(大鼠,Dragoco公司数据)或LD50如 6g/kg(大鼠,Merck公司数据)。
金合欢醇可有效抑制痤疮的形成,改善肌肤肤质,并可消除体臭和汗臭。Symrise公司已将金合欢醇作为天然除臭剂使用,抑菌选择试验表明,金合欢醇对汗臭产生菌有选择性的抑制作用,而且对产生痤疮(青春痘)的细菌、皮肤的丝状菌(导致发生湿疹和脚气的细菌)有抑制功效。金合欢醇在化妆品应用中的抑菌作用与传统杀菌概念不同,传统杀菌剂通常杀灭包括皮肤保护层的一切微生物,破坏皮肤的自然生态,长期使用会导致许多皮肤问题,如皮肤过敏、瘙痒等;并且会引起环境污染。天然来源的金合欢醇,温和抑菌。它仅抑制导致体癣、脚气、体臭、粉刺等皮肤问题的微生物,不破坏皮肤的天然保护层,维持皮肤自然生态,促进皮肤健康,被用于液体皂、沐浴液、护肤液和防晒霜等化妆品中。
金合欢醛的生物合成及其代谢路径[1]
像所有蛋白质一样,戊烯基化蛋白质的半衰期是有限的。然而,与其他蛋白不同的是,丙烯基化蛋白降解后释放法尼酰基半胱氨酸(FC)或香叶基香叶基半胱氨酸(GGC)。哺乳动物具有一种能催化FC和GGC氧化裂解的戊基半胱氨酸裂解酶。这种依赖fad的硫醚氧化酶消耗分子氧,并产生过氧化氢、半胱氨酸和戊醛产物(即金合欢醛或香叶基香叶醛)。在拟南芥中也存在类似的裂解酶。然而,由fly (At5g63910)基因编码的拟南芥酶对FC具有特异性(图1)。GGC的代谢机制不同。植物膜被证明含有金合欢醇激酶、香叶基香叶醇激酶、金合欢醇磷酸激酶和香叶基香叶醇磷酸激酶活性(图1)。这些膜相关激酶对核苷酸特异性不同,这表明它们是不同的酶(即金合欢醇激酶和香叶基香叶醇激酶可以使用CTP, UTP,或三磷酸鸟苷磷酰基供体,而通过磷酸激酶和香叶基香叶醇磷酸激酶展览CTP作为磷酰基供体特异性)。然而,目前还不清楚金合欢醇激酶是否与香叶基香叶醇激酶不同,也不清楚金合欢醇磷酸激酶是否与香叶香叶醇磷酸激酶不同。尽管如此,很明显,这些激酶将金合欢醇和香叶醇转化为它们的一磷酸和二磷酸形式,用于异戊二烯类生物合成,包括甾醇生物合成和蛋白质戊烯基化。
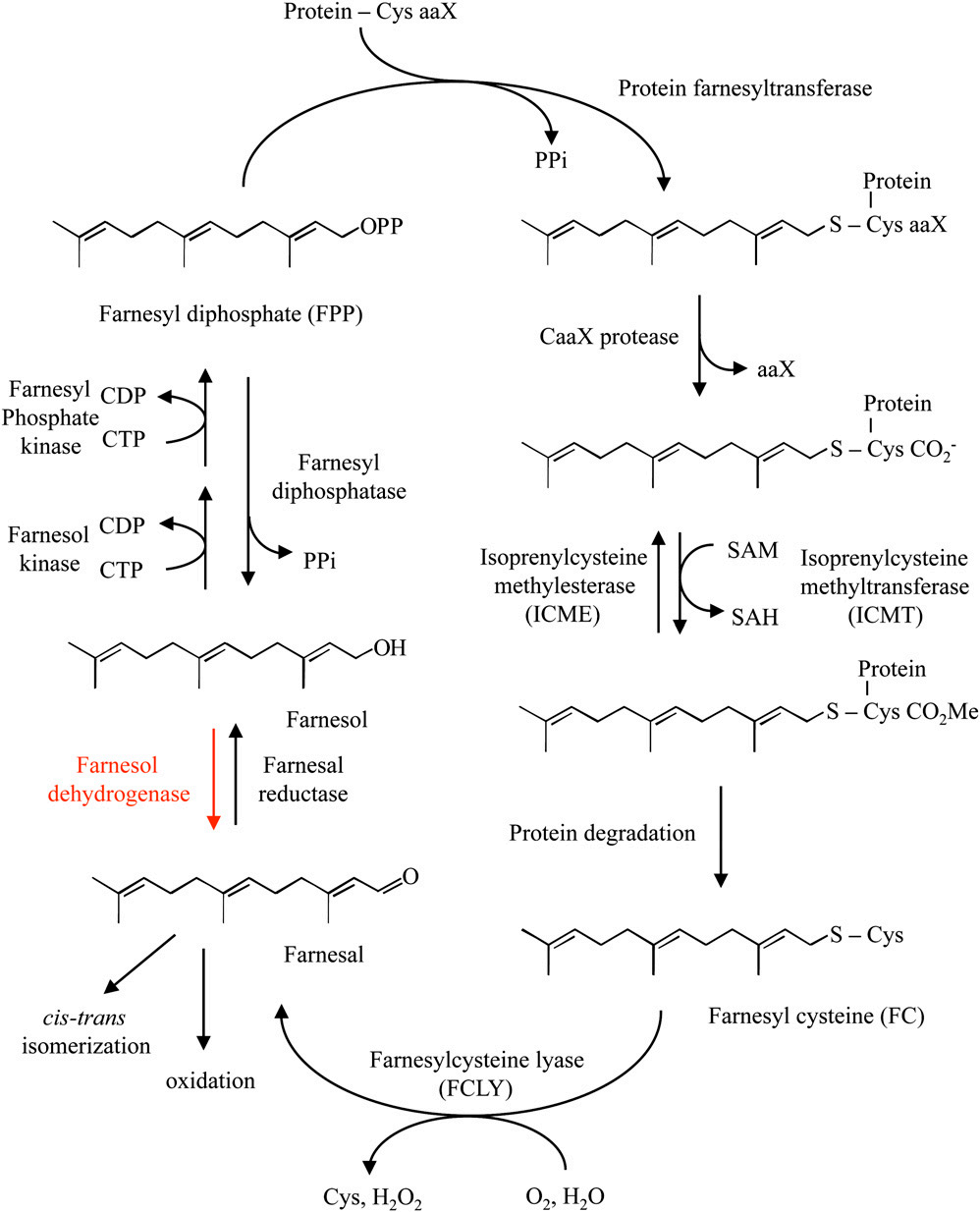
图1 提出的金合欢醛和金合欢醇的代谢。它与蛋白质的戊烯基化有关。红色显示的循环部分是本文的主题。
金合欢醇、金合欢醛的药学活性
1、非环倍半萜结构相关化合物的筛选及其抗菌和细胞毒活性
天然的非环倍半萜类化合物大多作为香料和调味料应用于香精工业。这一类包括香叶丙酮(1),橙花醇(2),金合欢醇(3),金合欢醛(4)和金合欢乙酸酯(5)。
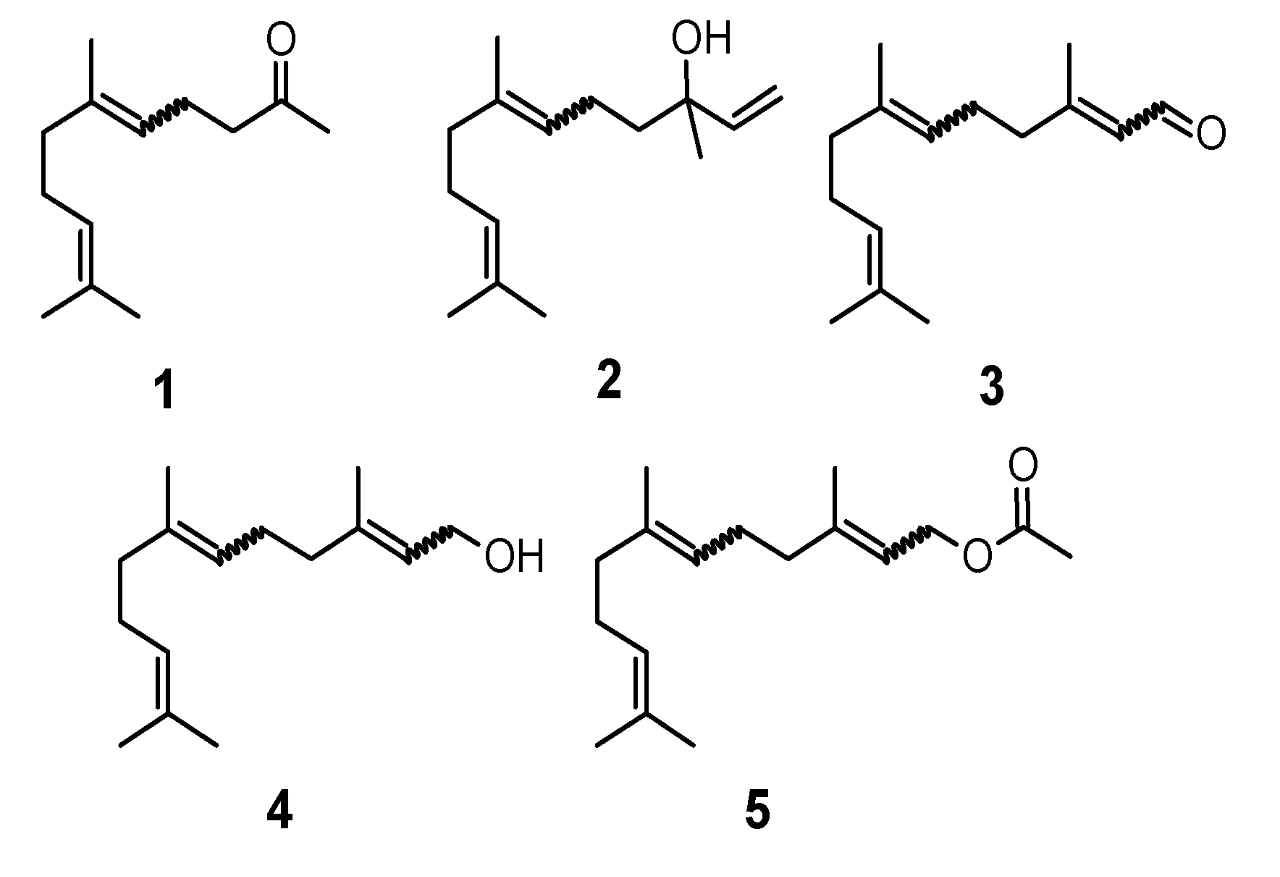
图1 (1)香叶丙酮;(2)橙花叔醇 ;(3)金合欢醛(法尼醛);(4)金合欢醇(法尼醇);(5)醋酸金合欢酯的结构。
橙花醇和金合欢醇除了具有风味特性外,还具有抗菌特性。许多乳霜和营养剂中都含有法尼醇,它对引起痤疮的细菌(金黄色葡萄球菌、表皮葡萄球菌)有抑菌作用,而且不会影响皮肤上自然存在的微生物群。它阻断耐药菌株金黄色葡萄球菌生物膜的形成,并与抗生素协同作用。Brilhante等研究表明,金合欢醇单独或联合抗真菌药物对球虫属二型真菌和念珠菌临床分离株具有抑制活性。橙花醇对肠道沙门氏菌、金黄色葡萄球菌、大肠杆菌和黑曲霉等具有一定的毒性作用,并能提高抗生素的抗菌活性。Nagaki等人检测了金合欢醛对金黄色葡萄球菌的活性,发现其在分析的萜类化合物中表现出最高的活性。Shin等人评价了乙酸金合花酯抑制金黄色葡萄球菌和铜绿假单胞菌生长的抗菌活性。通过对其食品防腐性能的研究表明香叶丙酮还具有抗菌性能。此外,天然倍半萜在体内和体外对人类癌症细胞株(特别是人类恶性黑色素瘤、早幼粒细胞白血病和肺癌)具有化学预防和化疗特性。
我们在之前报道了与香叶丙酮和橙花醇结构相关的化合物(图2),因为它们具有嗅觉和抗菌性能,是潜在的香味成分,按照目前的趋势,应该具有附加价值,特别是保存性能。因此可以减少或消除传统的化妆品防腐剂。
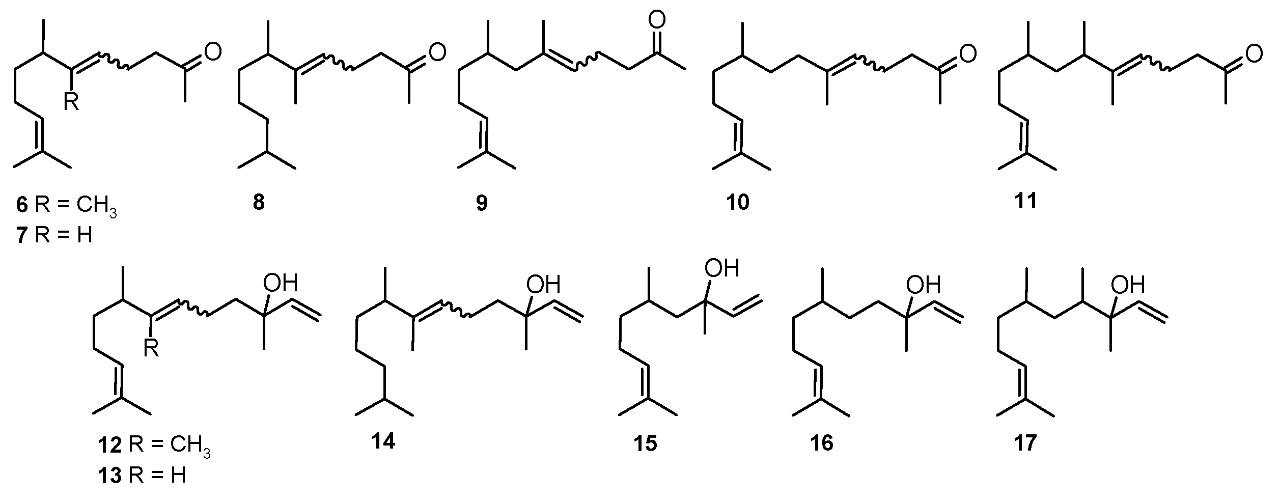
图2 化合物结构为香叶酮丙酮(6 ~ 11)和橙花醇(12 ~ 17)
从醇12-17[18]开始,通过叔烯丙基醇[21]的氧化重排,我们得到了一系列与法尼醛(18 - 23)结构相关的化合物(图3)。我们观察到得到的醛表现出很高的不稳定性,这在某种程度上可以从收率对分离方法的依赖中得到证实。蒸馏产物的得率为36% ~ 67%,硅胶柱层析纯化产物的得率为71% ~ 83%。此外,我们发现醛18-23在溶液中是相当稳定的。经GC和NMR分析,重排后的C-C双键的E/Z几何异构体比分别为2:1(18、19、20、23)和2:1(21、22)。核磁共振谱上最具特征和诊断性的信号是γ甲基取代基信号。对于E型同分异构体,由于羰基的脱屏蔽作用,1H化学位移较高(约2.1 ppm, Z型同分异构体约1.9 ppm)。另一方面,在E型异构体中,由于空间效应,碳原子的信号被上移(对于Z型异构体,约为17 ppm和25 ppm)。这些化合物的气味在结构上与法尼醛有关,或者更确切地说,与法尼醛的缺乏有关,这是令人惊讶的。唯一的例外是21的气味,浓郁的花香,带有脂肪和甜瓜的味道;23的气味,类似香叶丙酮(绿色、水果味、蜡味和木味)。

图3 金合欢醛(18 ~ 23)、金合欢醇(24 ~ 29)、金合欢乙酸酯(30 ~ 35)等结构相关化合物的合成。
用硼氢化钠还原得到的醛类化合物与金合欢醇结构相关(47% ~ 97%)。除29产物无臭外,其余产物均为淡淡花香。随后在三乙胺存在下与醋酸酐酯化,得到了结构上与金合欢乙酸酯相关的化合物(收率为69% - 90%),与结构上与金合欢酯相关的化合物一样,通常是无臭的,但有一个例外。化合物35有一种很淡的榅桲((果实金黄有涩味,可制果酱))香味。对所有有气味的化合物,我们还进行了GC-O测定实验。对香叶丙酮和橙花醇结构相关的化合物,异构体的气味描述没有明显差异。
对所有得到的化合物和亲本萜类化合物进行抑菌活性评价(表1所示)。香叶酮丙酮、橙花醇、酮6 ~ 11和醇12 ~ 17的数据在之前由我们提供。酮6 ~ 11对肠球菌属和革兰氏阴性菌的抑菌活性最高,最低抑菌浓度(MIC)在12 ~ 32µg/mL之间。亲本萜类金合欢醇及其相关的部分醇类及其乙酸酯具有相似的活性。对所有化合物的抗性最强的是金黄色葡萄球菌标准菌株ATCC 43300。虽然Togashi等人发现法尼醇在浓度为10 μg/mL及以上时对金黄色葡萄球菌FDA209P具有活性,但在他们的研究中,含1 × 105 CFU的菌悬液摇晃培养48小时,并监测比浊度。另一方面,Jin等人指出,金合醇对耻垢分枝杆菌mc2 155 ATCC 700084具有抑制活性,微量稀释后MIC值为64µg/mL,符合ncls指南。在我们的研究中获得的法尼醇的MIC值从16µg/mL到52µg/mL对所有测试的标准菌株。另一种萜类化合物及其结构相关化合物对标准细菌的抑制活性在12 ~ 54µg/mL之间。
对于合成的化合物,我们也通过柱层析(E)-(Z)-异构体富集馏分,根据GC,其中含有≥85%的适当异构体,但测定的生物活性(抗菌和细胞毒性)与混合物的没有显著差异(数据未提供)。以环丙沙星和庆大霉素作为对照。
表1 结构相关化合物及亲本萜类化合物对革兰氏阳性和革兰氏阴性对照菌株的抑菌活性。
| 最低抑制浓度 MIC (µg/mL) | ||||||
| 革兰氏阳性菌 | 革兰氏阴性菌 | |||||
| Staphylococcus aureus ATCC 43300 | Enterococcus faecalis ATCC 51299 | Enterococcus faecium ATCC 35667 | Escherichia coliATCC 25922 | Klebsiella pneumoniae ATCC 700603 | Acinetobacter baumanniiATCC 19606 | |
| 香叶丙酮(1) | 48 | 36 | 28 | 26 | 18 | 18 |
| 6 | 26 | 18 | 16 | 14 | 14 | 12 |
| 7 | 26 | 16 | 18 | 16 | 16 | 14 |
| 8 | 38 | 26 | 28 | 18 | 18 | 22 |
| 9 | 28 | 18 | 14 | 28 | 18 | 16 |
| 10 | 46 | 26 | 18 | 32 | 18 | 16 |
| 11 | 26 | 22 | 18 | 28 | 28 | 14 |
| 橙花叔醇 (2) | 48 | 38 | 32 | 46 | 16 | 26 |
| 12 | 48 | 46 | 42 | 40 | 28 | 26 |
| 13 | 46 | 42 | 38 | 40 | 20 | 22 |
| 14 | 48 | 38 | 36 | 38 | 18 | 28 |
| 15 | 46 | 48 | 38 | 28 | 16 | 16 |
| 16 | 48 | 38 | 36 | 32 | 24 | 22 |
| 17 | 48 | 38 | 38 | 46 | 18 | 16 |
| 法尼醛 (3) | 24 | 22 | 36 | 46 | 44 | 36 |
| 18 | 18 | 22 | 28 | 52 | 46 | 46 |
| 19 | 28 | 34 | 38 | 44 | 36 | 42 |
| 20 | 22 | 20 | 32 | 48 | 38 | 38 |
| 21 | 32 | 38 | 42 | 54 | 48 | 52 |
| 22 | 26 | 24 | 46 | 44 | 36 | 36 |
| 23 | 28 | 26 | 36 | 46 | 34 | 36 |
| 法尼醇(4) | 26 | 18 | 16 | 28 | 16 | 18 |
| 24 | 22 | 18 | 32 | 52 | 44 | 40 |
| 25 | 28 | 32 | 34 | 50 | 48 | 44 |
| 26 | 32 | 30 | 36 | 48 | 42 | 38 |
| 27 | 28 | 26 | 18 | 36 | 18 | 34 |
| 28 | 26 | 18 | 16 | 28 | 16 | 18 |
| 29 | 28 | 22 | 18 | 38 | 36 | 32 |
| 乙酸法尼酯 (5) | 28 | 20 | 20 | 28 | 22 | 22 |
| 30 | 30 | 24 | 18 | 30 | 24 | 24 |
| 31 | 24 | 20 | 20 | 26 | 22 | 18 |
| 32 | 28 | 22 | 20 | 28 | 18 | 22 |
| 33 | 26 | 18 | 16 | 26 | 18 | 22 |
| 34 | 32 | 20 | 18 | 18 | 20 | 18 |
| 35 | 34 | 16 | 14 | 16 | 18 | 12 |
| 环丙沙星 | 8 | 2 | 8 | 4 | 2 | 4 |
| 庆大霉素 | 16 | >64 * | 32 | 4 | 32 | 32 |
*检测的最高浓度为64µg/mL。
药效基团
有了大量关于抗菌活性(MICs)的数据,我们确定了定义所述化合物活性的可能的药效团模型(图4、图5、图6、图7、图8和图9)。
醛18对金黄色葡萄球菌ATCC 43300的活性最高,药效团由一个氢键受体(HBA,绿色)定义,它被四个排斥体(EV,灰色)和两个疏水体(H,绿色)包围(图4)。其中一个在氢键受体所指定的直线上,距离它5.7 Å,另一个距离HBA 12.4 Å。活性最低的化合物(1、2、12、14、16和17),在其可能的和有利的能量构象中,不填满一个离氢键受体更远的疏水分子。香叶丙酮(1)太短。在橙花醇(2)及其结构相关醇(12、14、16和17)靠近HBA的情况下,疏水性被乙烯基部分填充,这使得它不可能进一步填充疏水性。

图4 醛18排列于金黄色葡萄球菌活性化合物的药效团模型(左侧),最不活性化合物1、2、12、14、16和17(右侧)。
抑制粪肠球菌活性化合物的药效基团模型(图5)由一个HBA、两个疏水体和五个排除体积组成。在氢键受体附近应该没有空间位阻,这表明附近存在四个排除体。HBA与疏水体的距离分别为5.8和7.2 Å。在这种情况下,就像在抑制金黄色葡萄球菌活性化合物的药效基团模型中一样,活性最低的化合物并不填满一个疏水体,原因是空间和构象因素。此外,在最不活跃的情况下的结构与橙花叔醇12和15,它可以假定短长度的分子结合的官能团的位置在中间的链会导致降低这些化合物的活性。反过来,对于活性最高的酮7和乙酸35,适当的链长连接和官能团的暴露使这些化合物更有活性。
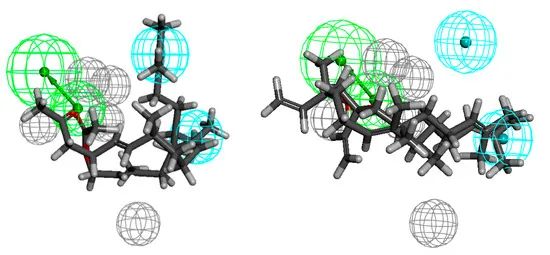
图5 结构上与香叶丙酮和醋酸金合花酯相关的化合物(7和35)与粪肠球菌活性化合物的药效团模型对齐(左侧),活性最低的化合物12和15(右侧)。
在分析的化合物中,对屎肠球菌最有效的是酮9和乙酸35。该药团由一个氢键受体、两个疏水体和五个除外体组成(图6)。两个疏水体均位于与HBA确定的直线垂直的线上,距离分别为6.9和10.0 Å。疏水化合物12和22活性低的原因是其中一种疏水化合物缺乏填充。这是由于与前两种情况相同的考虑。

图6 结构上与香叶丙酮和醋酸金合欢酯相关的化合物9和35与屎肠球菌活性化合物的药效团模型对齐(左侧),活性最低的化合物12和22(右侧)。
酮6对革兰氏阴性菌:大肠埃希菌、肺炎克雷伯菌和鲍曼不动杆菌活性最高。乙酸35对最后提到的菌株表现出同样的活性。药团由一个氢键受体、三个(大肠杆菌)或两个(其他两株)疏水体和五个(肺炎克雷伯菌)或两个除外体(分别图7、图8和图9)定义。对于大肠杆菌,疏水体包括C-6和C-7上的甲基取代基和异丁烯基部分;在肺炎克雷伯菌的情况下,甲基似乎发挥了重要的作用,他们适合疏水性。反过来,描述鲍曼不动杆菌活性分子空间需求的药效团表明了C-7甲基取代基和异丁烯基部分的重要作用。从HBA到疏水体的距离分别为5.5、7.2、9.0、3.4、4.2、5.8、6.1 Å(分别为大肠杆菌、肺炎克雷伯菌和鲍曼不动杆菌)。对于抗革兰氏阴性菌活性最低的化合物来说,药效团的问题似乎在于功能基团在链中的位置。当两个疏水体都被填满时,在每种情况下,官能团都会通过氢键受体发挥作用。虽然对于对革兰氏阳性菌有效的化合物,官能团的暴露是有益的,但在这里它并没有带来预期的效果。
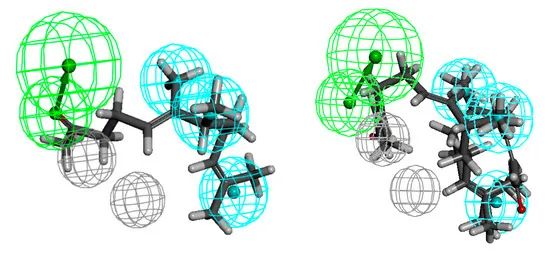
图7 与香叶丙酮6结构相关的化合物,排列在大肠杆菌活性化合物的药效团模型上(左侧),最不活性化合物18和21(右侧)。

图8 酮6排列在肺炎克雷伯菌活性化合物的药效团模型上(左侧),最不活性的18和21(右侧)。
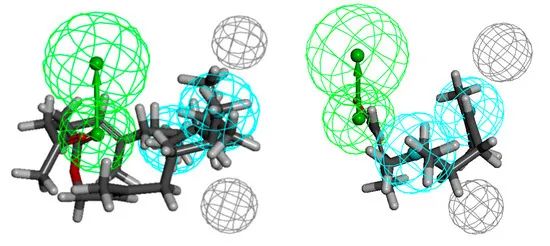
图9 结构上与香叶丙酮和醋酸金合花酯相关的化合物6和35排列在鲍曼不动杆菌活性化合物的药效团模型上(左边),最不活性的21(右边)。
仅对活性最强的物质进行药效团建模(图10)。得到的结果证实了前面所描述的关于所需链长度和官能团的阐述的观察结果。与使用本文描述的所有化合物所得到的更一般的模型相比,上述模型可被认为更具限制性。虽然这些模型的外观不同,但它们的分析得出了相同的结论。长链化合物具有较高的抗菌活性。此外,官能团的暴露一度是有利因素(对革兰氏阳性菌的活性),而在另一时刻则是不利因素(对革兰氏阴性菌的活性)。此外,在上述空间条件下,可以看出β-甲基取代基也起着重要的作用(在金黄色葡萄球菌的情况下)。
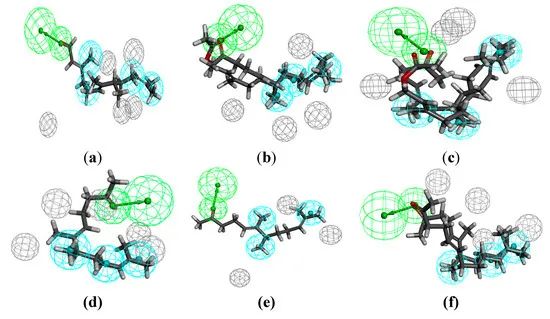
图10 对革兰氏阳性菌活性最强的化合物的药效团模型:金黄色葡萄球菌(a);粪肠球菌(b);屎肠球菌 (c)和对革兰氏阴性菌活性最强的化合物:大肠杆菌 (d);肺炎克雷伯氏菌(e);鲍曼不动杆菌 (f)。
亲本萜及其结构相关化合物的细胞毒性研究
所有获得的化合物和亲本萜类化合物作为阳性对照,另外使用一种流行的人白血病HL-60细胞体外模型进行细胞毒性(MTT试验)。香叶丙酮和橙花醇的细胞毒活性与已有报道的相近,但生物活性较低。对橙花醇(2)和香叶酮(1),IC50水平(即抑制50%细胞活力所需的化合物浓度)分别为135µM和295µM。我们的研究表明,橙花叔醇,合成结构相关的化合物(12 - 17)更加活跃细胞脱氢酶抑制剂相比基于香叶基丙酮化合物结构(表2)。12到17的IC50值醇在大致范围500µM - 750µM,除了16 (大约1000µM),香叶酮和合成酮6 ~ 11的含量大于1000 μ M。
表2 研究的化合物在24小时后对癌症和正常细胞代谢活动的浓度-反应效应(活力)
| Cancer Cell Lines | Normal Cell Lines | |||||
| Malignant Melanoma MEWO | Colorectal Adenocarcinoma HT29 | Promyelocytic Leukaemia HL‑60 | Fibroblasts HFIG | Keratinocytes HaCaT | Epithelium of the Small Intestine IEC6 | |
| Geranyl acetone (1) | 93% ± 4% | 98% ± 8% | 295 | 82% ± 7% | 89% ± 3% | 79% ± 6% |
| 6 | 102% ± 5% | 102% ± 6% | 67% ± 5% | 83% ± 2% | 118% ± 5% | 95% ± 7% |
| 7 | 99% ± 2% | 98% ± 2% | 67% ± 5% | 92% ± 8% | 101% ± 7% | 82% ± 3% |
| 8 | 94% ± 5% | 111% ± 3% | 72% ± 5% | 81% ± 9% | 90% ± 2% | 97% ± 5% |
| 9 | 83% ± 9% | 107% ± 8% | 69% ± 0% | 85% ± 6% | 89% ± 4% | 76% ± 2% |
| 10 | 93% ± 5% | 103% ± 9% | 62% ± 8% | 98% ± 7% | 112% ± 8% | 78% ± 4% |
| 11 | 112% ± 4% | 92% ± 1% | 59% ± 7% | 102% ± 3% | 100% ± 5% | 81% ± 5% |
| Nerolidol (2) | 99% ± 3% | 103% ± 8% | 135 | 75% ± 6% | 102 ± 5% | 76% ± 9% |
| 12 | 97% ± 5% | 97% ± 3 | 500 | 110% ± 7% | 101% ± 6% | 73% ± 8% |
| 13 | 83% ± 5% | 99% ± 6% | 400 | 87% ± 7% | 87% ± 6% | 96% ± 5% |
| 14 | 99% ± 6% | 112% ± 5% | 750 | 99% ± 4% | 106% ± 5% | 65% ± 8% |
| 15 | 104% ± 6% | 104% ± 7% | 750 | 96% ± 5% | 90% ±7% | 110% ± 3% |
| 16 | 100% ± 7% | 102% ± 3% | 950 | 106% ± 5% | 89% ± 4% | 113% ± 2% |
| 17 | 112% ± 0% | 108% ± 4% | 750 | 87% ± 5% | 95% ± 0% | 98% ± 5% |
| Farnesal (3) | 467 | 110% ± 9% | 363 | 650 | 702 | 85% ± 2% |
| 18 | 630 | 98% ± 9% | 502 | 690 | 800 | 79% ± 6% |
| 19 | 600 | 96% ± 2% | 550 | 750 | 650 | 94% ± 4% |
| 20 | 690 | 82% ± 6% | 480 | 610 | 850 | 64% ± 7% |
| 21 | 640 | 98% ± 6% | 600 | 830 | 830 | 91% ± 3% |
| 22 | 700 | 93% ± 3% | 600 | 740 | 880 | 76% ± 3% |
| 23 | 730 | 87% ± 7% | 630 | 800 | 900 | 82% ± 5% |
| Farnesol (4) | 378 | 930 | 54 | 350 | 489 | 58% ± 8% |
| 24 | 512 | 78% ± 6% | 100 | 390 | 686 | 85% ± 5% |
| 25 | 500 | 108% ± 11% | 167 | 454 | 667 | 82% ± 2% |
| 26 | 495 | 96% ± 5% | 145 | 531 | 620 | 76% ± 3% |
| 27 | 456 | 106% ± 2% | 143 | 489 | 687 | 93% ± 5% |
| 28 | 512 | 93% ± 8% | 198 | 687 | 698 | 101% ± 4% |
| 29 | 587 | 82% ± 2% | 252 | 756 | 946 | 103% ± 2% |
| Farnesyl acetate (5) | 734 | 105% ± 3% | 121 | 98% ± 7% | 102% ± 3% | 78% ± 7% |
| 30 | 850 | 96% ± 4% | 289 | 105% ± 3% | 900 | 86% ± 6% |
| 31 | 930 | 107% ± 8% | 350 | 850 | 98% ± 7% | 94% ± 5% |
| 32 | 800 | 103% ± 7% | 278 | 980 | 950 | 92% ± 4% |
| 33 | 103% ± 5% | 110% ± 9% | 400 | 100% ± 6% | 101% ± 6% | 95% ± 5% |
| 34 | 98% ± 6% | 98% ± 3% | 312 | 99% ± 3% | 110% ± 5% | 79% ± 3% |
| 35 | 112% ± 5% | 83% ± 5% | 343 | 87% ± 8% | 102% ± 4% | 71% ± 4% |
24小时后半数最大抑制浓度(IC50),内插值(加粗)。浓度范围:10-1000µM。如果IC50超过1000µM活力,在1000µM时给予[%]±标准差。
金合欢醇具有非常高的细胞毒性,因此它有可能被用作一种抗癌药物,这在之前对非小细胞肺癌细胞(H460和A549)进行的研究中得到了证实,这表明两种细胞系的IC50值约为4.5µM。对所有新合成的化合物进行细胞株活力比较,结果表明金合欢醇及其结构相关化合物具有最高的生物活性,尤其是对HL-60细胞株的活性,但合成的化合物均不如金合欢醇(IC50 = 54 μ M)。在较高浓度(IC50 = 289 ~ 630 μ M)时,与金合欢醛和金合欢酯相关的化合物的活性均低于金合欢醇,但对白血病细胞的代谢活性有抑制作用。所有研究的化合物对消化系统起源的上皮细胞系(结直肠腺癌HT29和小肠上皮细胞IEC6)几乎是无害的。
另一方面,考虑到这些新的合成化合物在香料和香料工业中的潜在用途,有必要对皮肤来源的细胞进行细胞毒性研究。众所周知,皮肤由不同类型的细胞组成,如角化细胞、黑素细胞和成纤维细胞;因此,测定了化合物对MEWO黑素细胞、永久化角质形成细胞HaCaT和正常人类成纤维细胞(HFIG)的细胞代谢活性的影响。在这种情况下,在测试的化合物浓度范围内,无法获得香叶醇丙酮、橙花醇及其结构相关化合物对所使用细胞系的IC50水平;这些值均大于1000µM。更重要的是,最高化合物浓度观察到的最大代谢抑制效应不超过15%(数据未显示)。Pohlit等人的研究表明橙花醇对其他人类黑色素瘤MDA/MB - 435细胞株和结肠癌HCT-8细胞没有毒性。这些数据表明,所获得的化合物可能可以安全地用于香精和香料成分。金合欢醛、金合欢醇和醋酸金合欢酯等结构相关化合物对皮肤细胞活力有一定影响,其IC50值为350 ~ 990 M;在研究的细胞系中,角质形成细胞是最不敏感的,然而,正常成纤维细胞和恶性细胞的结果是具有可比性的。当比较结果时,重要的是要强调HL-60细胞株对测试的化合物更敏感,而皮肤和消化系统来源的细胞(正常和不朽的)没有显示出代谢活性的显著降低。使用HL-60细胞作为单细胞模型可能会对这些化合物的生物活性给出错误的评价。
2、金合欢醇及其衍生物的化学和生物学:具有巨大治疗潜力的群体感应分子 [2]
背景:金合欢醇是一种通过麦角甾醇途径内源性合成的无环倍半萜醇。它是一种群体感应分子(QSM),首次在白色念珠菌中发现,并参与抑制菌丝形成。
方法:对金合欢醇及其衍生物的发生、化学/生物合成及生产调控因素进行综述。此外,还介绍了它们的细胞功能和多种生物医学应用。
结果:采用化学合成和代谢工程方法可实现金合欢醇的大规模生产。金合欢醇参与多种生理过程的调节,包括丝状细胞形成、生物被膜形成、药物外排和细胞凋亡等。金合欢醇及其衍生物/类似物也被报道具有抗生物膜、抗癌、抗肿瘤和杀菌性能。通过与已知的抗真菌药物协同作用,以及通过纳米配方,金合醇的抗菌潜力已得到增强。
结论:金合欢醇除具有群体感应活性外,还可作为一种有效的抗微生物、抗炎、抗过敏、抗癌和抗肥胖药物。
3、金合欢醇是一种中药倍半萜醇,对卵清蛋白致敏及应激性哮喘小鼠有抗炎及抗过敏作用[3]
为了研究金合欢醇对过敏性哮喘的作用,在卵清蛋白(OVA-)致敏和致毒的小鼠使用的AIN- 76饲料中添加3个剂量的金合醇,分别为5、25和100 mg金合醇/kg, BW/day,连续5周。结果表明:添加金合欢醇组与对照组的体重、采食量和内脏器官重量均无显著差异。添加金合欢醇可降低支气管肺泡灌洗液(BALF)中白细胞介素(IL)-6/IL-10水平。金合欢醇显著恢复了因OVA致敏和激发而被抑制的腹膜巨噬细胞的细胞因子分泌能力,略微降低了肿瘤坏死因子(TNF-α)/IL-10细胞因子的分泌比例。金合欢醇可轻微降低OVA作用下脾细胞分泌的IL-4水平,但显著提高IL-2水平,提示金合欢醇可能对过敏性哮喘小鼠具有全身抗过敏作用。金合欢醇显著提高了OVA存在下脾细胞分泌的IL-10水平,提示金合欢醇可能对过敏性哮喘小鼠具有抗炎作用。总之,我们的结果表明,补充金合醇可能有利于改善th2偏倚的过敏性哮喘炎症。

金合欢醇结构(a)和不同剂量的补充5周对OVA/ al致敏和激发BALB/c哮喘小鼠体重变化的影响(b)。数值为平均值±SD (n = 12 - 15)。同一实验点各实验组间差异有统计学意义(P < 0.05),采用单因素方差分析,Duncan 's new multiple range test。NSC, nonsensitized控制;直流、饮食控制;PC,阳性对照(地塞米松,3 mg/kg BW, 0.3 mL/小鼠灌胃);FL,低剂量金合欢醇(在AIN-76饲料中为0.003%);FM,中剂量金合欢醇(在AIN-76饲料中为0.017%);FH,高剂量金合欢醇(在AIN-76饲料中为0.067%)。[3]
4、p21Cip1和p27Kip1介导异戊二烯类紫苏醇、香叶醇和金合欢醇在人胰腺腺癌细胞中的细胞周期阻滞
胰腺癌是美国癌症相关死亡的第四大原因,通常出现在晚期,化疗通常难以治愈。因此,对这种疾病的新疗法有很大的需求。天然衍生的类异戊二烯类紫苏醇、金合醇和香叶醇对胰腺和其他类型的肿瘤具有化疗潜力。然而,它们在这些系统中的作用机制还没有完全定义。在本研究中,我们研究了类异戊二烯对细胞周期的影响,并观察了三种化合物之间类似的抗增殖作用机制。首先,当联合使用时,类异戊二烯表现出对MIA PaCa-2人胰腺癌细胞的增生性抑制作用。此外,所有这三种化合物诱导G0/G1细胞周期阻滞,与细胞周期蛋白激酶抑制剂蛋白p21Cip1和p27Kip1表达的增加以及细胞周期蛋白a、细胞周期蛋白B1和细胞周期蛋白依赖性激酶(Cdk) 2蛋白水平的降低相一致。免疫沉淀研究表明,p21Cip1和p27Kip1与Cdk2的相关性增强,以及类异戊二烯暴露后Cdk2激酶活性降低,表明p21Cip1和p27Kip1在胰腺腺癌细胞中具有细胞周期抑制作用。当siRNA被用于抑制MIA PaCa-2细胞中p21Cip1和p27Kip1蛋白的表达时,对所有三种异戊二烯类化合物的条件抗性都很明显。鉴于在该细胞系和BxPC-3人胰腺腺癌细胞中的类似发现,我们得出结论,化疗类异戊二烯化合物紫苏醇、金合醇和香叶醇在人胰腺腺癌细胞中激活p21Cip1-和p27kip1依赖的抗增殖机制。

类异戊二烯和类异戊二烯组合对人胰腺腺癌细胞株的抗增殖作用。将MIA PaCa-2 (A和C)和BxPC-3 (B)细胞暴露于含有POH (0-800 μM)、FOH (0-120 μM)或GOH (0-500 μM)的培养基中24 h。类异戊二烯的抗增殖作用也是一个时间依赖的过程,因为对MIA PaCa-2的抗增殖作用随着异戊二烯(C-E)暴露时间的延长而增加。类异戊二烯组合的抗增殖作用(F)表现为加性作用。误差条,平均值±S.E.M. *,与未处理对照组相比P≤0.05。†,P≤0.05,高剂量单剂异戊二烯与低剂量。[yen], P≤0.05。§,P≤0.05类异戊二烯联合用药与低剂量单药类异戊二烯(n≥5)。
参考文献
[1] Bonikowski R, Świtakowska P, Sienkiewicz M, Zakłos-Szyda M. Selected Compounds Structurally Related to Acyclic Sesquiterpenoids and Their Antibacterial and Cytotoxic Activity. Molecules. 2015; 20(6):11272-11296. https://doi.org/10.3390/molecules200611272
[2] Gupta Payal , Sharma Meenakshi , Arora Neha, Pruthi Vikas and Poluri Mohan Krishna *, Chemistry and Biology of Farnesol and its Derivatives: Quorum Sensing Molecules with Immense Therapeutic Potential, Current Topics in Medicinal Chemistry 2018; 18(22) . https://dx.doi.org/10.2174/1568026619666181210124 159
[3] Chi-Mei Ku, Jin-Yuarn Lin. Farnesol, a Sesquiterpene Alcohol in Herbal Plants, Exerts Anti-Inflammatory and Antiallergic Effects on Ovalbumin-Sensitized and -Challenged Asthmatic Mice. Evidence-based Complementary and Alternative Medicine, 2015(1):1-12. DOI: 10.1155/2015/387357.
[4] Dean A. Wiseman, Sean R. Werner and Pamela L. Crowell.
Cell Cycle Arrest by the Isoprenoids Perillyl Alcohol, Geraniol, and Farnesol Is Mediated by p21Cip1 and p27Kip1 in Human Pancreatic Adenocarcinoma Cells. Journal of Pharmacology and Experimental Therapeutics, 2007, 320 (3) 1163-1170; DOI: https://doi.org/10.1124/jpet.106.111666