服务热线
177-5061-9273

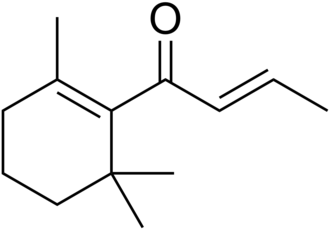
β-突厥酮 CAS号:23726-91-2
IUPAC名称:(E)-1-(2,6,6-三甲基-1-环己烯基)丁-2-烯-1-酮
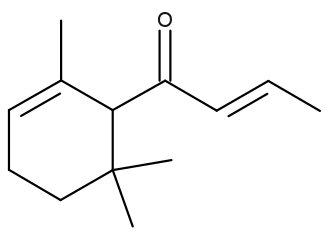
α-突厥酮 CAS号:24720-09-0
IUPAC名称:(E)-1-(2,6,6-三甲基-1-环己-2-烯基)丁-2-烯-1-酮
分子式:C13H20O
分子量:192.30 g·mol−1
α-突厥酮
理化性质:无色至黄色液体,不溶于水,溶于乙醇等有机溶剂,沸点81~82 ℃(常压),闪点101 ℃,相对密度d4(20)0.932~0.938,折射率nD(20)1.490~1.502。
天然存在:存在于茶叶的香气成分中,属天然等同香料。
香气特征:具有甜的果香、青香、花香、木香和浆果香气。
应用:可用于调配浆果、杏子、干果等香精,在烟用香精中也有使用。
参考用量:在最终加香食品中的建议用量为0.2~0.5 mg/kg。
安全管理情况:FEMA编号为3659,CoE编号为 385,中国GB I1258。
delta-突厥酮(delta-Damascone) 别名:1-(2,6,6-三甲基-3-环己烯基)-2-丁烯-1-酮,分子式:C13H20O,相对分子质量:192.29。
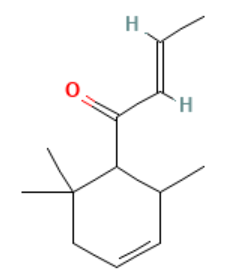
理化性质:无色至黄色液体,不溶于水,溶于乙醇等有机溶剂,沸点97 ℃(400 pa),闪点101 ℃,相对密度d4200.925~0.935,折射率nD201.488~1.495。
天然存在:属天然等同香料。
香气特征:具有木香、甜的果香、药草香气和薄荷样凉气。
应用:可用于调配浆果、覆盆子等配方中。
参考用量:在最终加香食品中的建议用量为0.005~0.1 mg/kg。
安全管理情况:FEMA编号为3622,CoE编号为 386,中国GB I1260。
突厥酮是是多种精油的组成成分。突厥酮属于一个化学家族,亦被称为玫瑰酮,其中也包括突厥烯酮和紫罗兰酮。尽管它的浓度相对较低,但它是玫瑰香气的一个贡献者,是香水中使用的一种重要的香味化学物质。突厥酮来源于类胡萝卜素的降解。
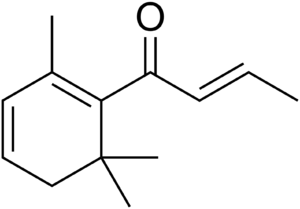
β-突厥烯酮
IUPAC名称:(E)-1-(2,6,6-三甲基-1-环己-1,3-二烯基)丁-2-烯-1-酮
CAS号:23726-93-4,或23696-85-7
分子式:C13H18O
分子量:190.286 g·mol−1
突厥烯酮,在香精中加入少量就能起到提升玫瑰香气的作用。具有较强的花香香气和良好的扩散力。主要用于调配高级化妆品和食品香料。
色状:淡黄色至黄色液体
香气:非常强力的花香果香型,突厥烯酮闻起来有玫瑰、梅子、葡萄、覆盆子、糖果的香气和强烈的天然花香、果香气息。
密度(20℃):0.946 - 0.952
折光率(20℃):1.51 - 1.514
闪点:>100℃ 含量:≥98%
突厥烯酮是多种精油的组成成分。突厥烯酮属于一个化学家族,也被称为玫瑰酮,其中还包括突厥酮和紫罗兰酮。β -突厥烯酮是玫瑰香气的主要贡献者,尽管它的浓度很低,是香水中使用的一种重要的香味化学物质。突厥烯酮是由类胡萝卜素降解而来。2008年,(E)-β-突厥烯酮被鉴定为肯塔基波旁威士忌的主要气味物质。
β-突厥烯酮的生物合成
β-突厥烯酮的生物合成开始于farnesyl法尼基焦磷酸(FPP)和异戊烯基焦磷酸(IPP)反应生成香叶酰香叶酰焦磷酸(GGPP)图1。
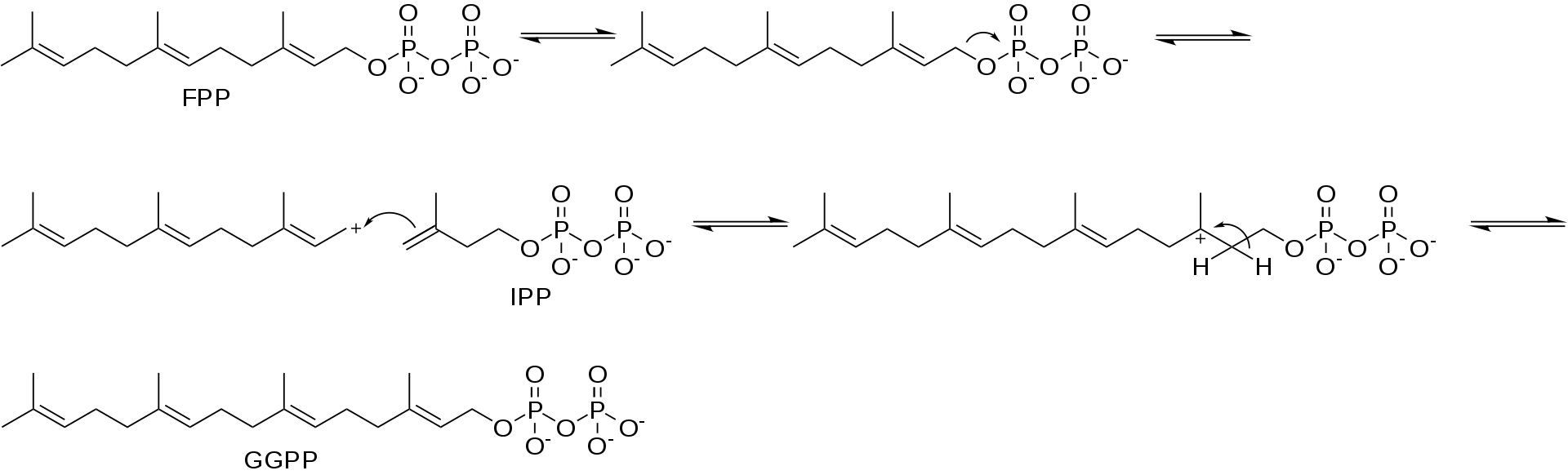
图1:GGPP合成
接下来,GGPP的两个分子通过去除二磷酸和质子移位酶(PSY)的催化作用缩合在一起生成八氢番茄红素。八氢番茄红素然后通过一系列的去饱和反应使用八氢番茄红素去饱和酶(PDS)来产生六氢番茄红素然后ζ-胡萝卜素。其他催化该反应的酶包括CrtI和CrtP。下一个系列的去饱和反应是由酶ζ-胡萝卜素去饱和酶(ZDS)催化产生链孢红素和番茄红素。其他能够催化这一反应的酶包括CtrI和CrtQ。接下来,番茄红素通过使用番茄红素β-环化酶进行两次环化反应,首先生成γ-胡萝卜素,然后再环化生成β-胡萝卜素,如图2所示。
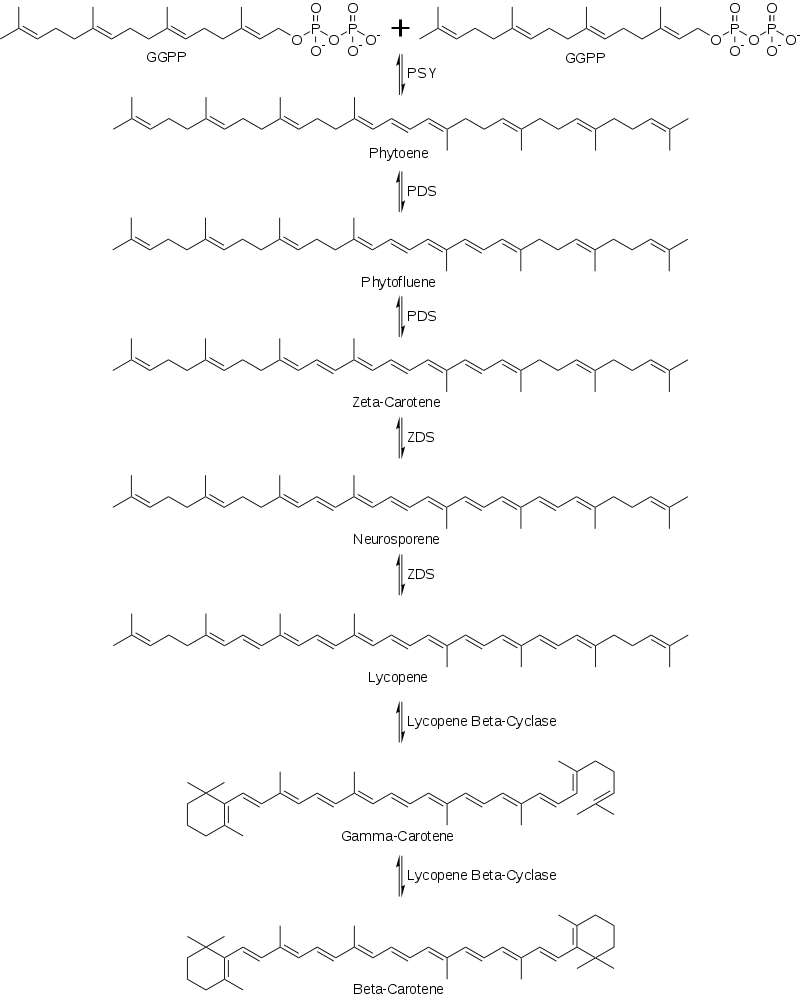
图2:-胡萝卜素的合成
番茄红素环化生成β-胡萝卜素的机理见示意图1。
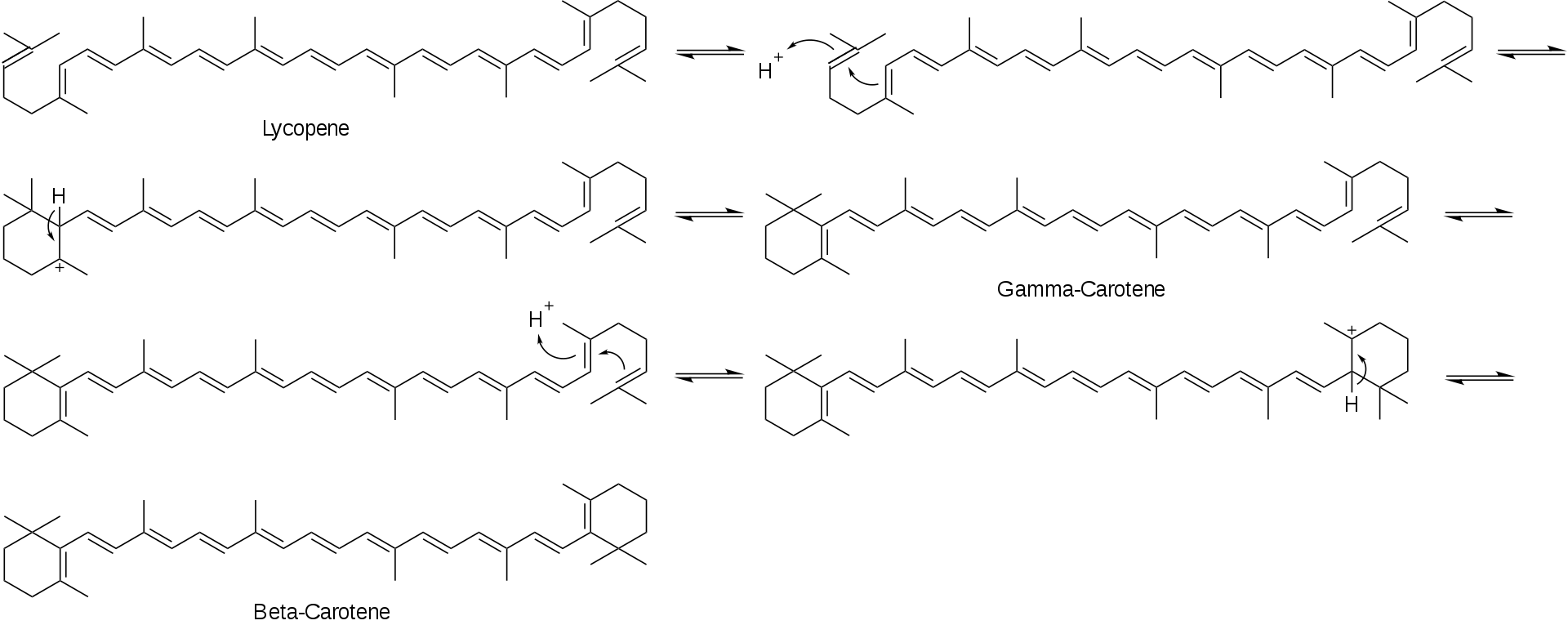
示意图1:β-胡萝卜素的生成机制
然后β-胡萝卜素与O2和β-胡萝卜素环羟化酶反应产生玉米黄质然后玉米黄质与O2、NADPH (H+)和还原铁氧还蛋白[铁硫]簇在玉米黄质环氧化酶(ZE)存在下反应生成玉米黄质,玉米黄质以类似的方式反应生成紫黄质。然后紫黄质与新黄质合酶反应形成新黄质,这是β-突厥烯酮的主要前体,如图3所示。
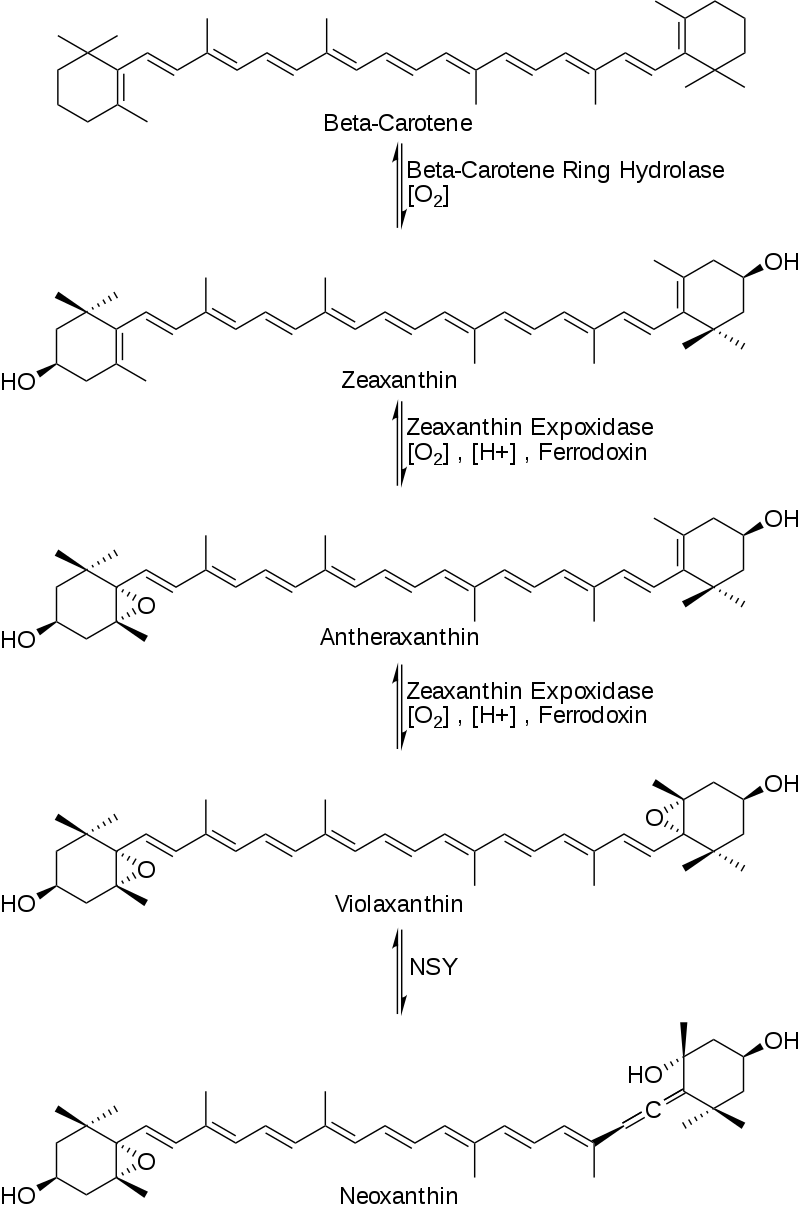
图3:新黄质合成
为了从新黄质中得到β-突厥烯酮,还需要进行一些修饰。首先,新黄质进行氧化裂解,生成蚱蜢酮。然后蚱蜢酮经过还原生成丙烯三醇。在这一阶段,丙烯三醇主要通过两条途径产生最终产物。丙烯三醇可以经过脱水反应生成乙炔二醇或丙烯二醇。最后,乙炔二醇或丙烯二醇的最后一个脱水反应生成β-突厥烯酮,如图4所示。
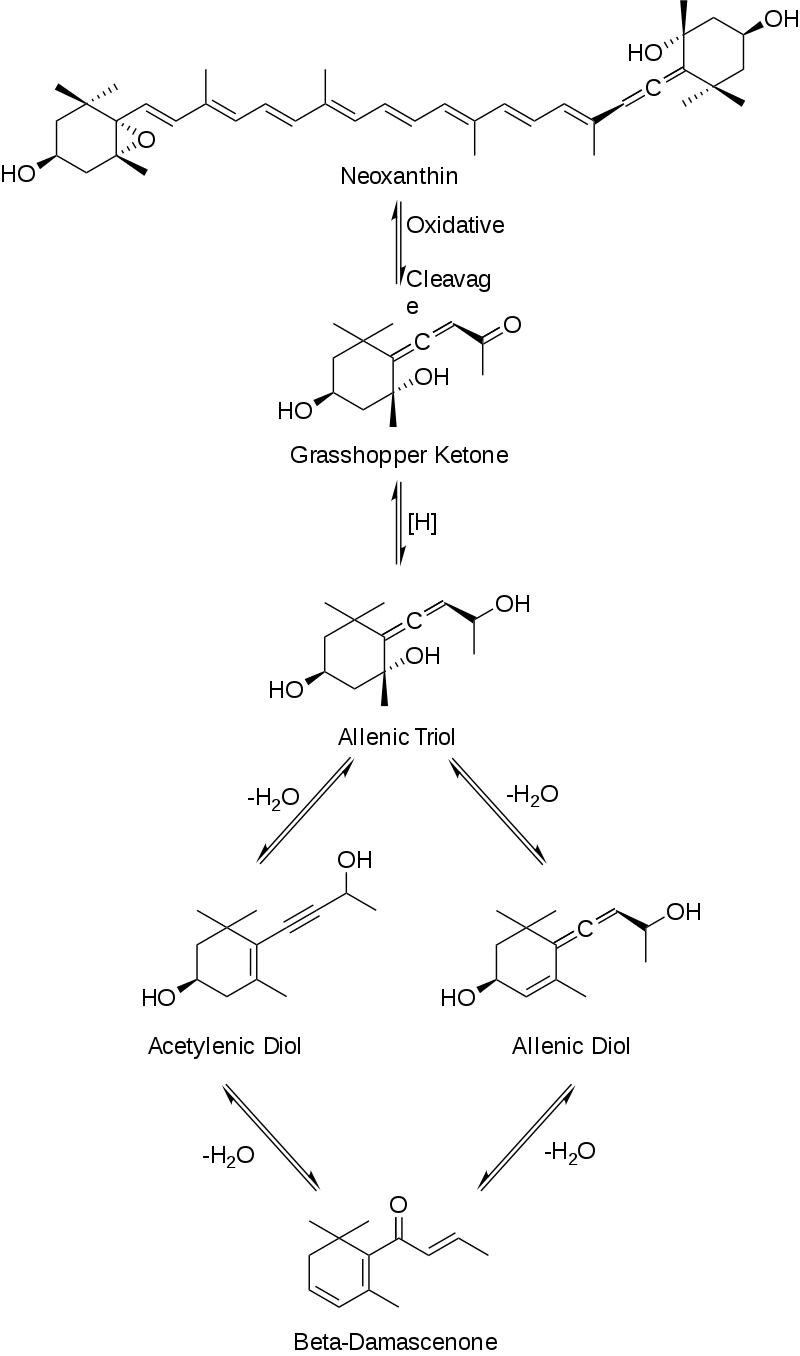
图4:β-突厥烯酮的合成
丙烯三醇转化为乙炔二醇的机理见示意图3。
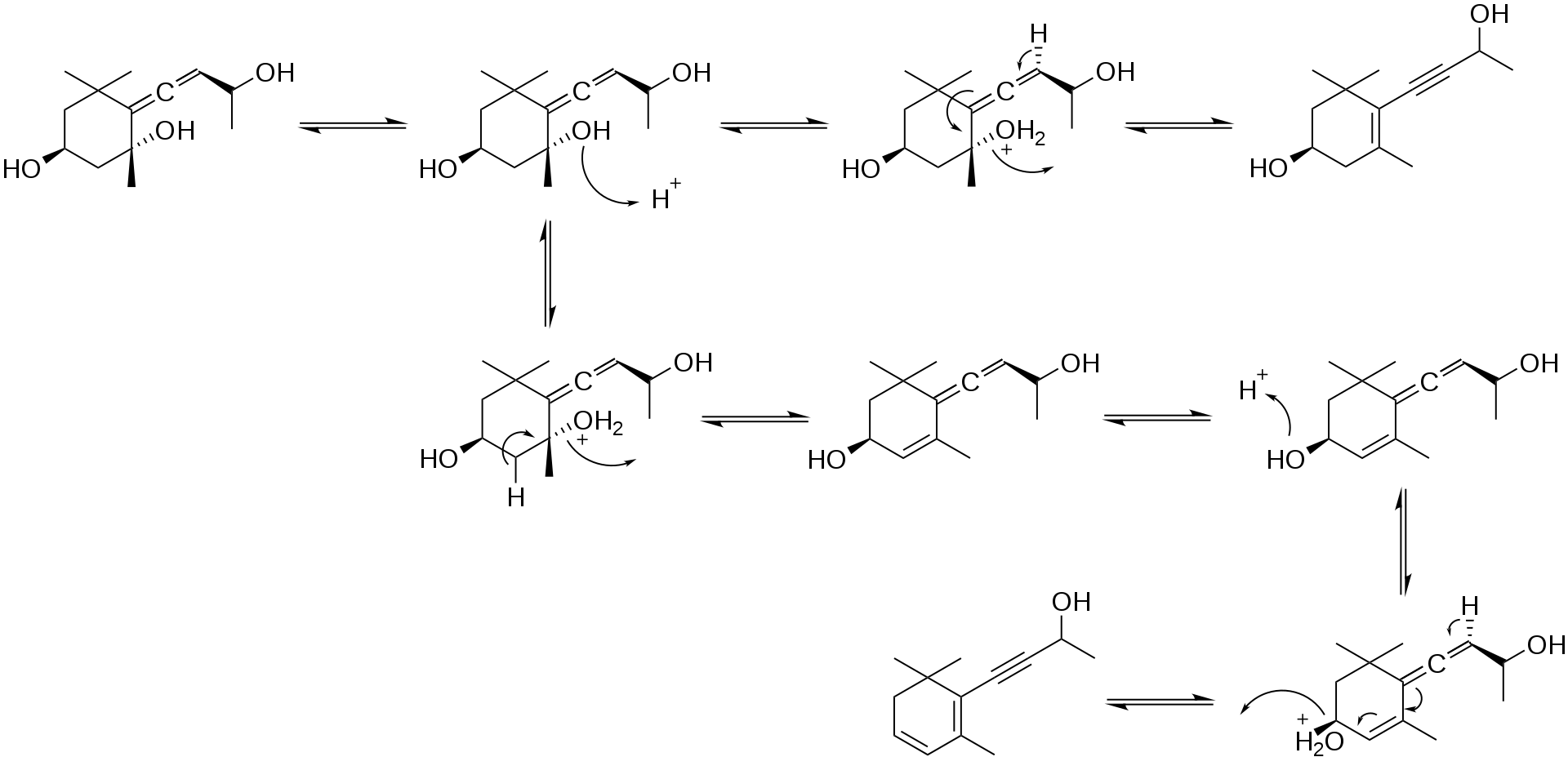
示意图2:乙炔二醇的生成机理
乙炔二醇转化为最终产物的假设机理见示意图3。
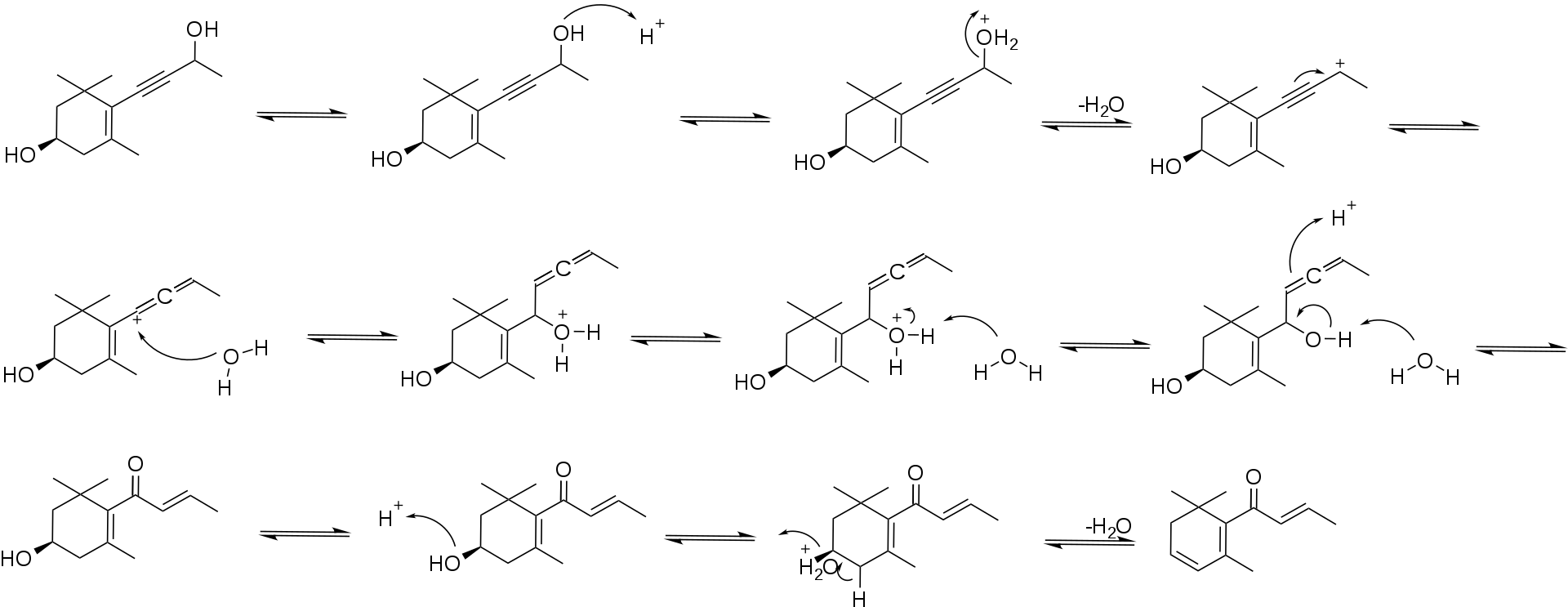
示意图3:β-突厥烯酮的生成机制。这种机制被称为Meyer-Schuster重排。
突厥酮或突厥烯酮的香气或药理活性
1、网络药理学鉴定及实验验证金花茶抗结肠癌活性成分及作用机制
金花茶(Camellia nitidissima Chi, CNC)是一种具有抗癌作用的中药。然而,其抗结肠癌(CC)的潜在机制尚不清楚。因此,本研究提出了一种基于网络药理学和实验验证的系统方法来阐明CNC的抗癌机制。最初,基于口服生物利用度(OB)和药物相似性(DL)术语,通过TCMSP数据库验证CNC的潜在活性成分。CNC的Hub靶基因从SwissTarget prediction和TCMSP数据库中获取,CC相关靶基因从GeneCards和OMIM数据库中收集。利用Cytoscape构建复合靶网络。然后,通过GO和KEGG分析从CNC和CC中采集的枢纽靶基因。GO和KEGG分析结果显示,槲皮素和木犀草素在CNC、VEGFA和AKT1靶点以及PI3K-Akt通路中与CC的抑制有关。分子对接结果显示,在所有的结合结果中,VEGFA的结合亲和力最强。通过体外HCT116细胞模型实验成功验证了这一发现。总之,本研究证明了网络药理学与体外实验相结合在阐明中药潜在分子机制方面的有效性。
金花茶中含有的活性成分如下表所示。
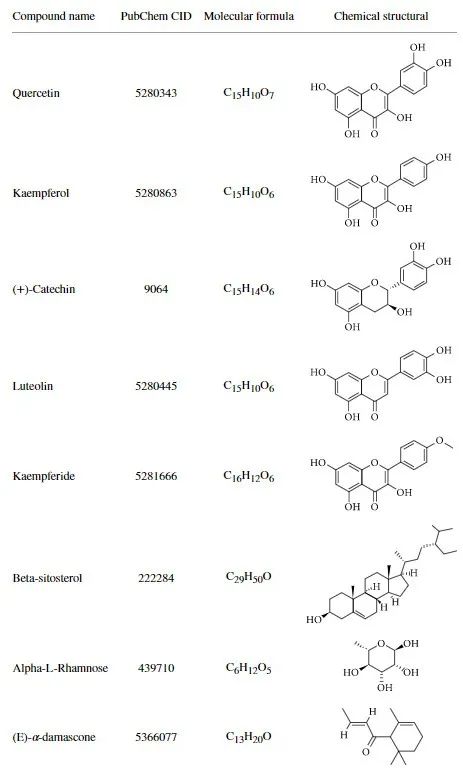
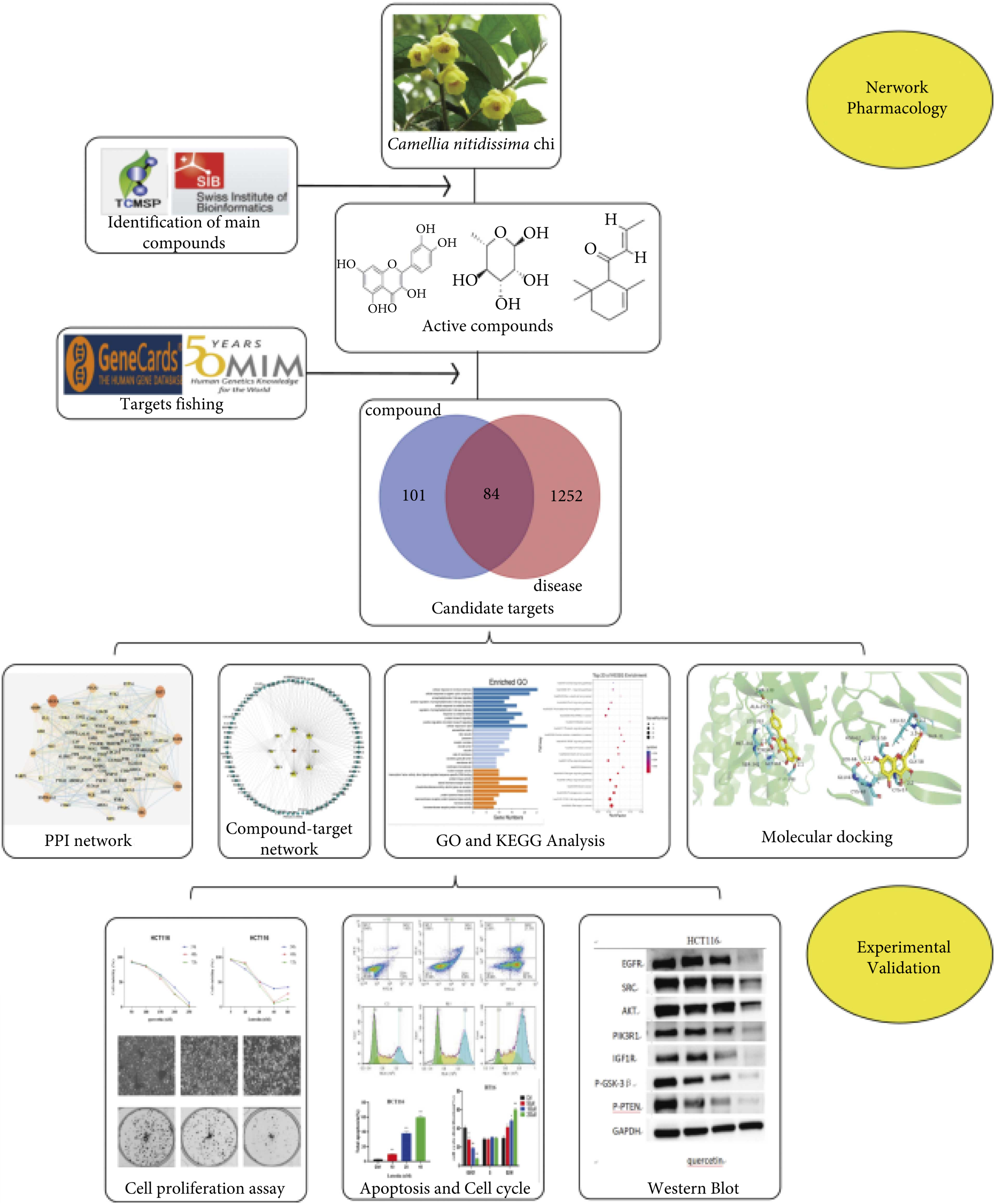
本研究初步阐明了金花茶抗结肠癌作用的化学成分和机理。与其他抗结肠癌中药相比,金花茶具有高效、低毒的特点。它在民间被用作茶来治疗各种疾病,历史悠久。现代药理实验也表明金花茶具有广泛的安全性,对小鼠无明显毒副作用。本研究为金花茶治疗结肠癌的临床应用提供了证据,同时首次利用网络药理学结合体外研究方法系统研究金花茶对抗结肠癌的机制。这为阐明结肠癌的抗癌机制提供了科学依据。由于培养环境的不同,体外培养的细胞不能完全等同于体内培养的细胞,其生物学行为也不尽相同。因此,单细胞培养不足以得出一个普遍的结论,需要结合体内实验得出更可靠的结论。网络药理学分析结果显示(E)-α-突厥酮、槲皮素、木犀草素、山奈素和山奈酚是通过调控VEGFA、AKT1、EGFR和SRC蛋白抑制结肠癌活性的主要活性成分。GO和KEGG分析发现,PI3K-Akt和激酶信号通路是关键靶点的主要下游机制通路。此外,分子对接结果显示木犀草素与VEGFA的结合能力最好,槲皮素次之。此外,体外细胞实验证明木犀草素具有比槲皮素更强的抗结肠癌作用,抑制细胞增殖和集落形成,诱导细胞凋亡和细胞周期阻滞。木犀草素抗cc的机制可能与其靶向VEGFA,抑制PI3K-Akt信号通路抑制下游信号传递的能力有关。本研究证明了多组分、多靶点、多途径的金花茶可以有效治疗结肠癌。但本研究仍存在一些不足之处。目前的工作缺乏体内实验,这将在后续研究中得到进一步验证。此外,还应研究金花茶的总提取物,而不是少数单一的化学成分。[1]
2、β-紫罗兰酮和β-突厥烯酮对黑比诺葡萄酒香气感知的潜在影响
挥发性化合物是葡萄酒产生香气的原因。由于其感知阈值较低,降异戊二烯类物质可能在葡萄酒香气中发挥重要作用。研究表明β-突厥烯酮可能作为一种香味增强化合物。然而,对葡萄酒香气的直接影响尚不清楚。本研究探讨了β-紫罗兰酮和β-突厥烯酮对黑比诺葡萄酒香气感觉的直接影响。三角测试被用来确定评估者是否能够在三种不同的黑皮诺葡萄酒基质中区分不同浓度的β-紫罗兰酮和β-突厥烯酮。描述性分析对这些处理,被认为是不同的三角形测试。结果表明,β-紫罗兰酮在黑比诺葡萄酒中起着重要的香味贡献作用,因为个体可以区分低浓度和高浓度的葡萄酒与对照。β-紫罗兰酮如何影响葡萄酒的香气取决于葡萄酒基质,因为不同的香气描述符会根据所使用的模型葡萄酒受到影响,从而产生花香、红莓或黑莓的香气。β-突厥烯酮对黑比诺香气的影响不太清楚,因为感知似乎很大程度上受葡萄酒基质组成的影响。这项研究有助于我们理解黑比诺葡萄酒中果香的复杂化学原因。[2]
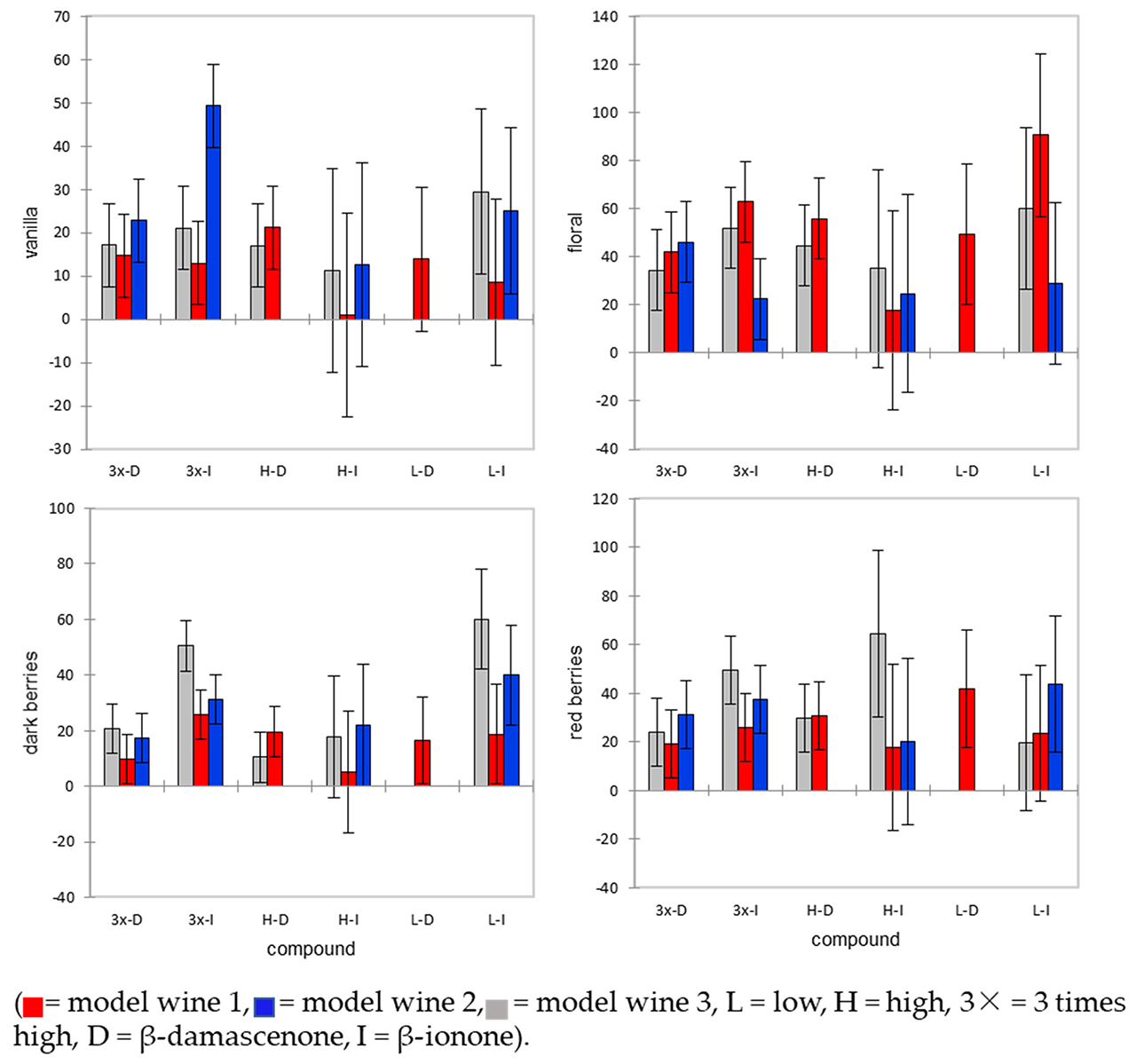
各感官属性之平均值及标准差。添加β-紫罗兰酮和β-突厥烯酮是如何通过评估的每个属性的平均值和标准偏差来改变香气的(上图)。模型葡萄酒之间香草香气的主要差异是MW1具有更高的香草强度。在α = 0.05时,3×-I表现出明显的香草香气增强。对于黑莓香气,L-I和3×-I与其他复合添加剂不同。此外,在这些化合物组中,黑莓的感觉是不同的基于模型葡萄酒。例如,在L-I内,MW1的黑莓强度显著低于MW2和MW3。[2]
结果表明,β-突厥烯酮和β-紫罗兰酮在三种浓度下改变了黑比诺葡萄酒的香气感知。特别是,β-紫罗兰酮的低浓度改变了三种黑比诺模型葡萄酒的香气。水中的低浓度(0.1µg/L)是目前已知的阈值0.09µg/L。然而,混合物(如葡萄酒)的复合阈值往往高于简单的解决方案(如水)。虽然这些添加了β-紫罗兰酮的葡萄酒可以与三角形测试中的对照品区分开来,但描述性分析的结果表明,葡萄酒基质也在感知中发挥作用。例如,在MW1中,L-I增加了花的香气,但在MW2中,红莓的L-I最强,而在MW3中,黑莓的香气最普遍。β-紫罗兰酮在西班牙红葡萄酒中被认为能积极地增强红浆果的香气,而β-紫罗兰酮纯化合物的描述性香气是花香。β-紫罗兰酮被发现与酯结合可以改变红莓的香气。当β-紫罗兰酮的浓度被增大了(3倍),酿酒师对此的感觉是否定的。专业的酿酒师使用负面的描述,如“腐烂的百花香”和“发霉的”来描述含有这种夸大浓度的样品(数据未显示)。在大多数化合物浓度和模型葡萄酒中都发现了这种感知香气类型的变化,这表明与其他香气化合物的某种类型的相互作用也改变了葡萄酒的香气。[2]
β-突厥烯酮对葡萄酒香气的影响在文献中有很多讨论。一些研究表明β-突厥烯酮在红酒香气中发挥了重要作用,而另一些研究表明它是一种香气增强剂化合物,可以提高其他香气成分的作用。研究的葡萄酒基质的差异可以解释文献中关于葡萄酒中存在β-突厥烯酮的不一致的发现。与β-紫罗兰酮的结果不同,β-突厥烯酮的结果显示葡萄酒基质对其感知的影响更大,不同添加浓度不能分辨不同基质模型的葡萄酒。香气的差异描述符根据β-突厥烯酮浓度没有发现统计学意义(上图)。β-突厥烯酮出现的最高强度的花香,接着是红浆果的香味。我们的结果表明,葡萄酒基质确实影响β-突厥烯酮的感知。[2]
同样,测试这两种化合物3倍浓度的主要原因之一是为了确定增加含量是否对葡萄酒的感官品质有积极或消极的影响,因为园艺或酿造管理技术已被用于增加葡萄和葡萄酒的含量。已经证明,改变葡萄微气候的栽培措施会对葡萄和葡萄酒的类降异戊二烯浓度产生影响[23,24]。然而,文献中的结果仍然不一致。Feng等人的研究表明,有强有力的证据表明,集群日照增加与黑比诺葡萄酒中β-突厥烯酮含量的提高有关。然而,Lee et al.表明赤霞珠中降甲异戊二烯水平受叶片层数的强烈影响,且与日照无关。另一项由Song et al.报道的研究表明,阳光照射对β-紫罗兰酮几乎没有正面影响,而对β-突厥烯酮没有影响。在之前的研究中,人们讨论了不一致的处理时间,减少了叶片层数,增加了对植株的日照,这可能是造成这种差异的原因。β-突厥烯酮水平的增加也可能是由于未成熟葡萄中有更多的类胡萝卜素前体可供稍后被分解。最近的一项研究表明,阳光可以促进β-紫罗兰酮的积累,但不能促进β-突厥烯酮的积累。[2]
虽然似乎可以改变葡萄和葡萄酒中β-紫罗兰酮和β-突厥烯酮的含量,但我们的感官结果表明,为了获得特定的感官品质,重点关注改变葡萄酒其他成分因素的做法是很重要的。此外,我们的结果还表明,为了预测黑比诺的感觉品质,有必要弄清楚基质相互作用,改变这两种化合物的感觉品质。单独而言,这些化合物并不能预测特定的香气品质。
我们想指出,小组成员对化合物的敏感性的影响是重要的。在这项研究完成后,我们再次尝试招募那些在低浓度下无法感知β-紫罗兰酮的葡萄酒消费者。这将如何改变人们对葡萄酒中这些化合物的看法,这将是一件有趣的事情。我们无法招募到足够多的对β-紫罗兰酮不敏感的葡萄酒消费者来进行感官试验。这为未来探索葡萄酒消费者对香味的敏感性提出了一个有趣的假设。[2]
3、麒麟叶C13大柱香波龙烷衍生物:β-突厥烯酮抑制促炎细胞因子和白细胞粘附分子的表达以及NF-κB信号转导
麒麟叶Epipremnum pinnatum

Epipremnum pinnatum. Common name: Dragon-Tail Plant. 麒麟叶 (Chinese)

Wild form "Rhaphidophora pinnata/Epipremnum aureum/Epipremnum pinnatum. Mt. Archer National Park.
为了鉴定其活性成分并了解其作用方式,我们检测了麒麟叶提取物抑制内皮细胞和单核细胞样细胞(HUVECtert和THP-1)炎症基因表达的能力。利用PTGS2 (COX-2) mRNA的表达进行生物活性引导的分离,分离得到两种C13大柱香波龙烷苷,gusanlungionside C(1)和citroside a (3),和苯基醇糖苷苯甲基-2- o- (6- o-鼠李糖基)-ß- d -半乳糖苷(2)。进一步分析确定了6个额外的大柱香波龙烷苷和苷元β-突厥烯酮(10)、大柱香波龙烷烯酮(11)、3-羟基-β-突厥烯酮(12)和3-氧代-7,8-二羟基-α-紫罗兰醇(13)。药理分析表明,10抑制lps刺激的HUVECtert和THP-1细胞中编码促炎细胞因子和白细胞黏附分子的mrna的诱导,如TNF-α、IL-1β、IL-8、COX-2、e -选择素、ICAM-1和VCAM-1。10抑制HUVECtert和THP-1细胞中炎症基因的诱导,不同的激动剂,如TNF-α, IL-1β和LPS。除了mRNA,炎症蛋白的上调也被10抑制,这是由细胞表面e -选择素和分泌的TNF-α的免疫试验证明的。最后,使用荧光素酶报告基因构建,结果显示10抑制NF-κ b依赖的转录。因此,我们推测β-突厥烯酮(10)对NF-κB的抑制作用可能是麒麟叶提取物体外抗炎活性的机制之一。[3]
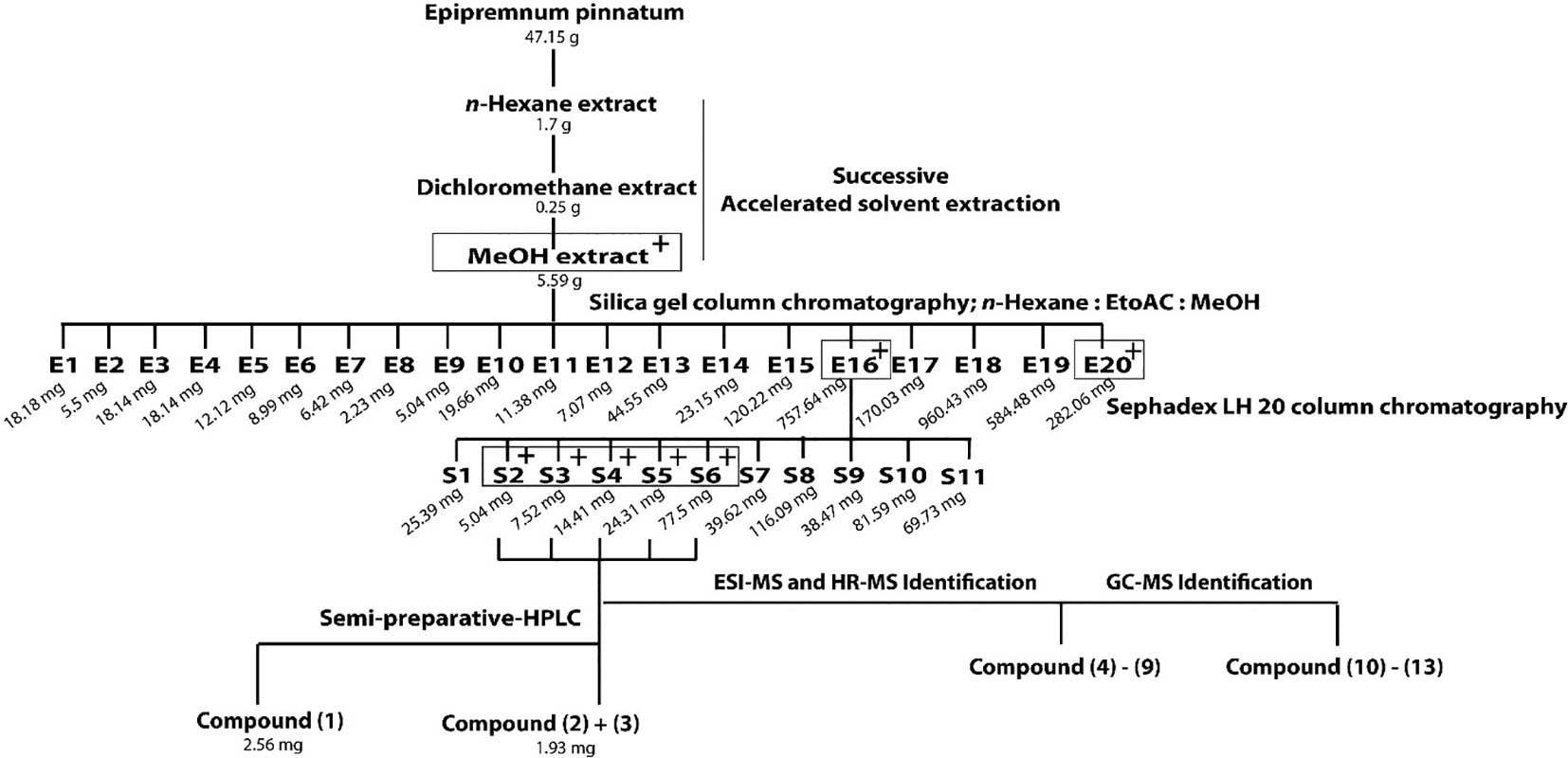
麒麟叶抗炎成分的提取与分离方法。用正己烷、二氯甲烷和甲醇依次萃取植物原料。活性甲醇提取物在硅胶柱上进一步分馏得到E1-E20。E16馏分在Sephadex LH20柱上分离得到S1-S11馏分。活性最强的部分(S2-S6)分别分离出1和2、3的混合物。化合物4-9和10-13经ESI-MS、HR-MS和GC-MS鉴定。利用COX-2 mRNA的qPCR分析确定活性组分,灰框中以“+”表示。[3]
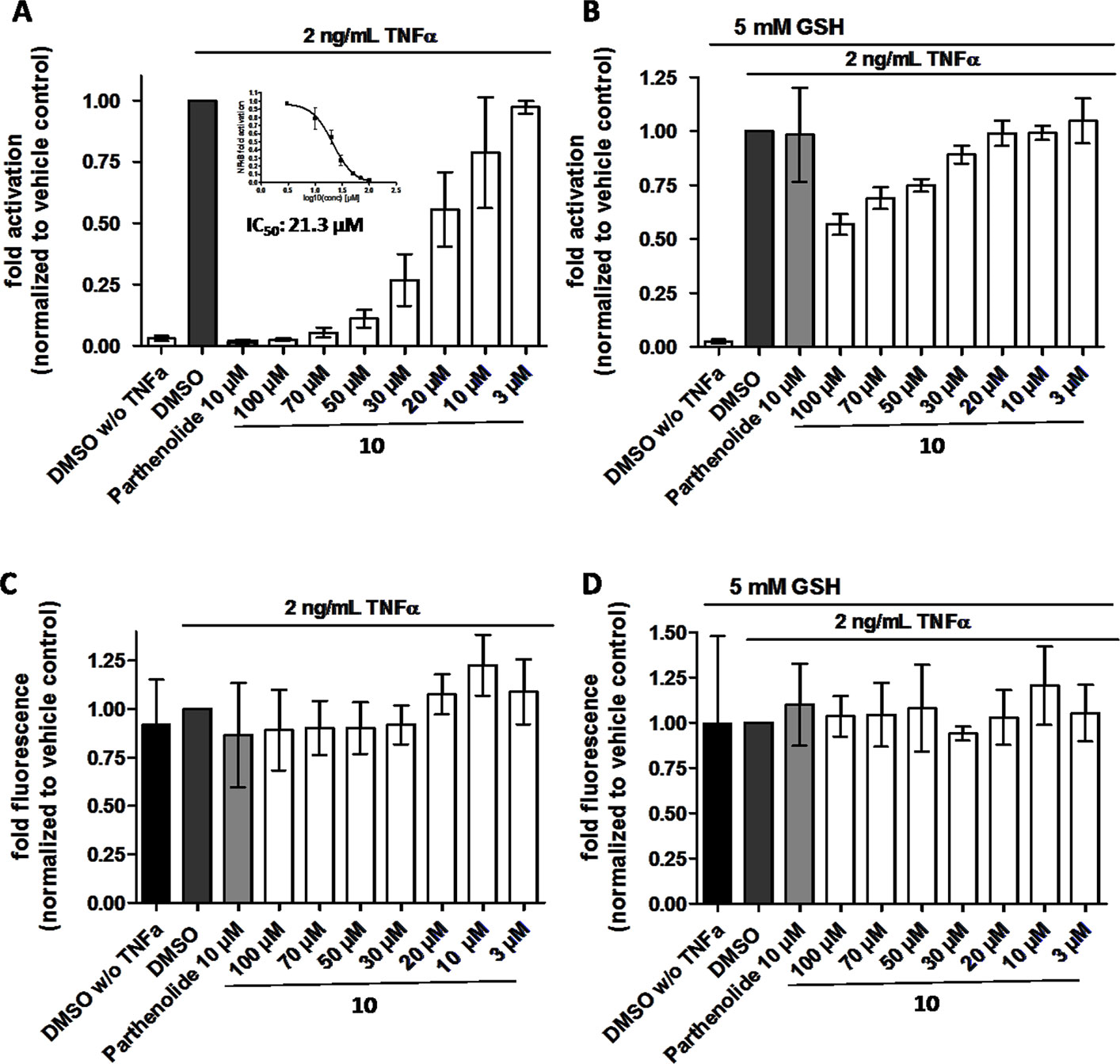
β-突厥烯酮(10)依赖抑制TNF-α (2 ng/ml)诱导的NF-κ b驱动的荧光素酶报告基因转录激活浓度;在存在5 mM谷胱甘肽(GSH)时,抑制作用被逆转。HEK293/NF-κB-luc细胞上载细胞追踪器绿(CTG),用于活体染色。24小时后,细胞用所示化合物预处理1小时,在(B)中加入5 mM GSH(如所示),并用TNF-α (2 ng/ml)激活4小时。然后分别测定(A、B)荧光素酶活性和(C、D) CTG荧光。荧光素酶活性归一化为CTG荧光。小白菊内酯(Parthenolide)(10µM)为阳性对照。数据以平均值±SD (n = 4)表示,并归一化为空白对照DMSO。[3]
4、功能性香料中聚(苯乙烯-马来酸酐)生物偶联物突厥酮的控释研究
用聚环氧丙烷(PO)-环氧乙烷(EO)侧链(Jeffamine®)对聚苯乙烯-马来酸酐进行了改性,改性后的EO/PO的摩尔比在0.11 - 3.60之间。这些共聚物随后被δ-突厥酮的β-巯基酮功能化。以聚马来酸单酰胺基β-巯基酮为释放体系,采用1,4加成法对δ-突厥酮进行缓释。采用动态顶空分析研究了棉表面沉积后包含织物阳离子表面活性剂配方,软化功能的环氧乙烷(EO)、环氧丙烷(PO)接枝共聚物侧链的摩尔比率对δ-突厥酮(一种家用的挥发性生物活性分子玫瑰酮)的释放。在典型的织物软化应用中,EO/PO侧链的极性影响突厥酮释放效率。研究发现,不含Jeffamine®侧链的富PO共聚物和相应的聚(苯乙烯-马来酸酐)的香味释放效率低于侧链EO/PO比例为3.60的相应生物偶联物。这种共聚物偶联物似乎代表了亲水性和疏水性之间的适当平衡,有利于δ-突厥酮的释放,并改善共轭物从水环境在棉花表面的沉积。[4]
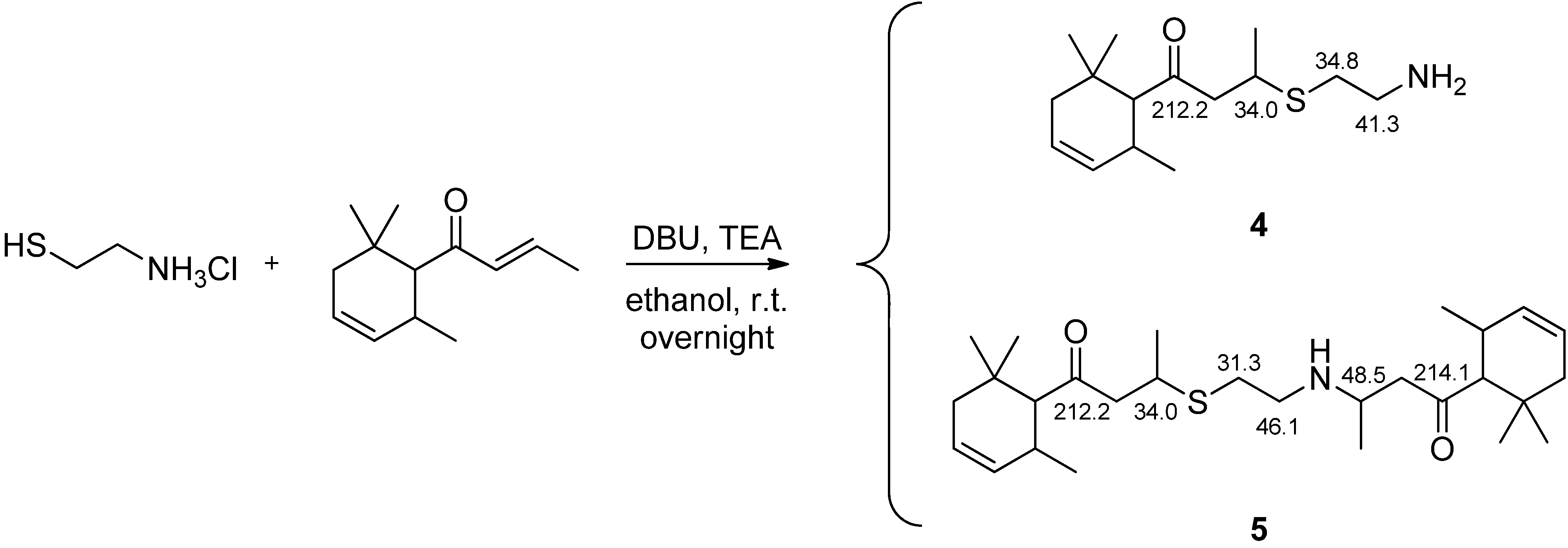
3-(2-氨基乙基硫代)-delta-突厥酮(4)的合成及二加合物的形成[4]
参考文献
[1] Yiwei Chen, Erwei Hao, Fan Zhang, Zhengcai Du, Jinling Xie, Feng Chen, Chunlin Yu, Xiaotao Hou, Jiagang Deng, "Identifying Active Compounds and Mechanism of Camellia nitidissima Chi on Anti-Colon Cancer by Network Pharmacology and Experimental Validation", Evidence-Based Complementary and Alternative Medicine, vol. 2021, Article ID 7169211, 15 pages, 2021. doi.10.1155/2021/7169211
[2]Tomasino E, Bolman S. The Potential Effect of β-Ionone and β-Damascenone on Sensory Perception of Pinot Noir Wine Aroma. Molecules. 2021; 26(5):1288. doi.10.3390/molecules26051288
[3]Pan San-Po, Pirker Teresa, Kunert Olaf, Kretschmer Nadine, Hummelbrunner Scarlet, Latkolik Simone L., Rappai Julia, Dirsch Verena M., Bochkov Valery, Bauer Rudolf.C13 Megastigmane Derivatives From Epipremnum pinnatum: β-Damascenone Inhibits the Expression of Pro-Inflammatory Cytokines and Leukocyte Adhesion Molecules as Well as NF-κB Signaling.Frontiers in Pharmacology,2019,10,DOI.10.3389/fphar.2019.01351.
[4]Berthier DL, Paret N, Trachsel A, Fieber W, Herrmann A. Controlled Release of Damascone from Poly(styrene-co-maleic anhydride)-based Bioconjugates in Functional Perfumery. Polymers. 2013; 5(1):234-253. https://doi.org/10.3390/polym5010234