服务热线
177-5061-9273

鸢尾酮(Irones)是一种可以用在香水中的紫罗兰酮有机化合物,是由鸢尾油提炼而成,商业上最重要的有:
(-)-顺-γ-鸢尾酮
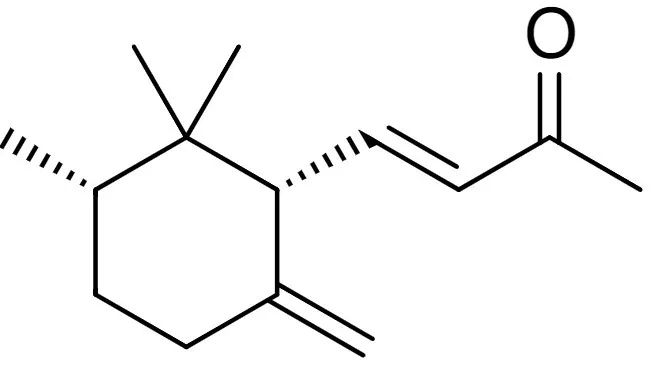
(-)-顺-α-鸢尾酮

鸢尾酮一般是将干燥的鸢尾属根茎中提炼的类萜缓慢氧化而成,多半会有甜的花香,或是木质的紫罗兰酮气味。

鸢尾烯(irene)是分子式为(CH3)4C10H8的芳香烃化合物,是由鸢尾酮脱水制得。鸢尾酮及鸢尾烯都是香水制造可能用到的原料。
一、概况
中文名:鸢尾酮,甲位-鸢尾酮;5-甲基-甲位-紫罗兰酮;5-甲基-乙位-紫罗兰酮;5-甲基-丙位-紫罗兰酮;4-(2,5,6,6-四甲基-2-环己烯-1-基)-3-丁烯-2-酮;4-(2,5,6,6-四甲基-1-环己烯-1-基)-3-丁烯-2-酮;4-(2-亚甲基-5,6,6-三甲基-环己烯-1-基)-3-丁烯-2-酮。
英文名:irone;6-Methylionone; Methylionone
分子式:C14H22O
分子量:206.33
CAS:79-69-6
FEMA:2597
鸢尾酮是一种名贵的香料。有α-、β-和γ-三种异构体,并有顺式、反式和旋光异构体。存在于鸢尾根油(菖蒲油)中,但β-鸢尾酮只有微量。一般商用的鸢尾酮含酮量应大于97%,其中α-鸢尾酮约为93%。值得注意的是还有一种香料叫鸢尾香酮的,鸢尾香酮与鸢尾酮是两种不同的香料,应该加以区别。鸢尾香酮的CAS编码是 67801-38-1,分子式为C13H20O。
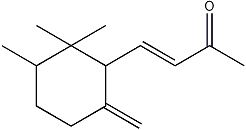
γ-鸢尾酮
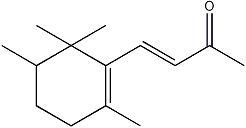
β-鸢尾酮
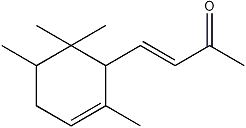
α-鸢尾酮
鸢尾香酮
二、理化指标
外观:无色至淡黄色油状液体。
香气:具有特有的类似鸢尾和紫罗兰的香气。有紫罗兰、鸢尾、桂花的甜香,是鸢尾油的主要香气。
比重:0.931-0.937
折光率:1.500-1.503
闪点:≥100℃
沸点:248℃
溶解性:几乎不溶于水。溶于油和醇。以1:4溶于70%乙醇。
三、制备
主要采用合成法。可由以2,3-二甲基-2-庚烯-6-酮和乙炔为原料,经合成而得。也可由二甲基丁二稀和异戊二烯制得。将二甲基丁二烯进行氢氯化反应生成二甲基丁二烯的氢氧化物,再与异戊二烯调聚反应得到甲基香叶基氯。甲基香叶基氯与乌洛托品反应得到6-甲基柠檬醛,再与丙酮在碱性介质中缩合假性鸢尾酮,进而环化得到鸢尾酮。也可从鸢尾根、复盆子、海桐花等天然原料中,经分离提取而得。
1、关环反应合成鸢尾酮
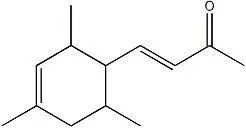
胡铁等研究了以 9,10-环亚甲基假紫罗兰酮为原料,经关环反应合成鸢尾酮的工艺,并对该关环反应机理进行了初步探讨。实验结果表明,适宜的工艺条件为:反应温度-70℃,物料摩尔比n(9,10-环亚甲基假紫罗 兰酮):n(氯磺酸)为1:4,反应45min,鸢尾酮的收率为90.1%。产品中 α-鸢尾酮、β-鸢尾酮和 γ-鸢尾酮的含 量分别为60.2%、29.0%和8.0%(GC,峰面积归一化法);采用NMR确证了 α-鸢尾酮的结构。关环反应机理 的初步探讨表明关环反应应在低温下快速完成。
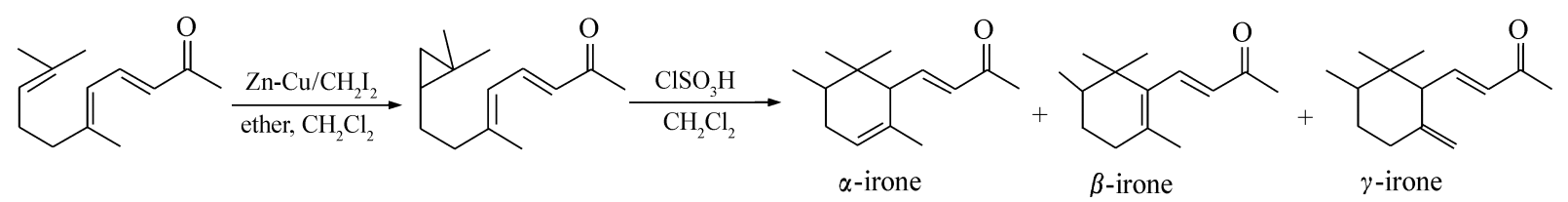
图1 以假紫罗兰酮为原料,通过环亚甲基化和关环两步反应合成鸢尾酮[1]
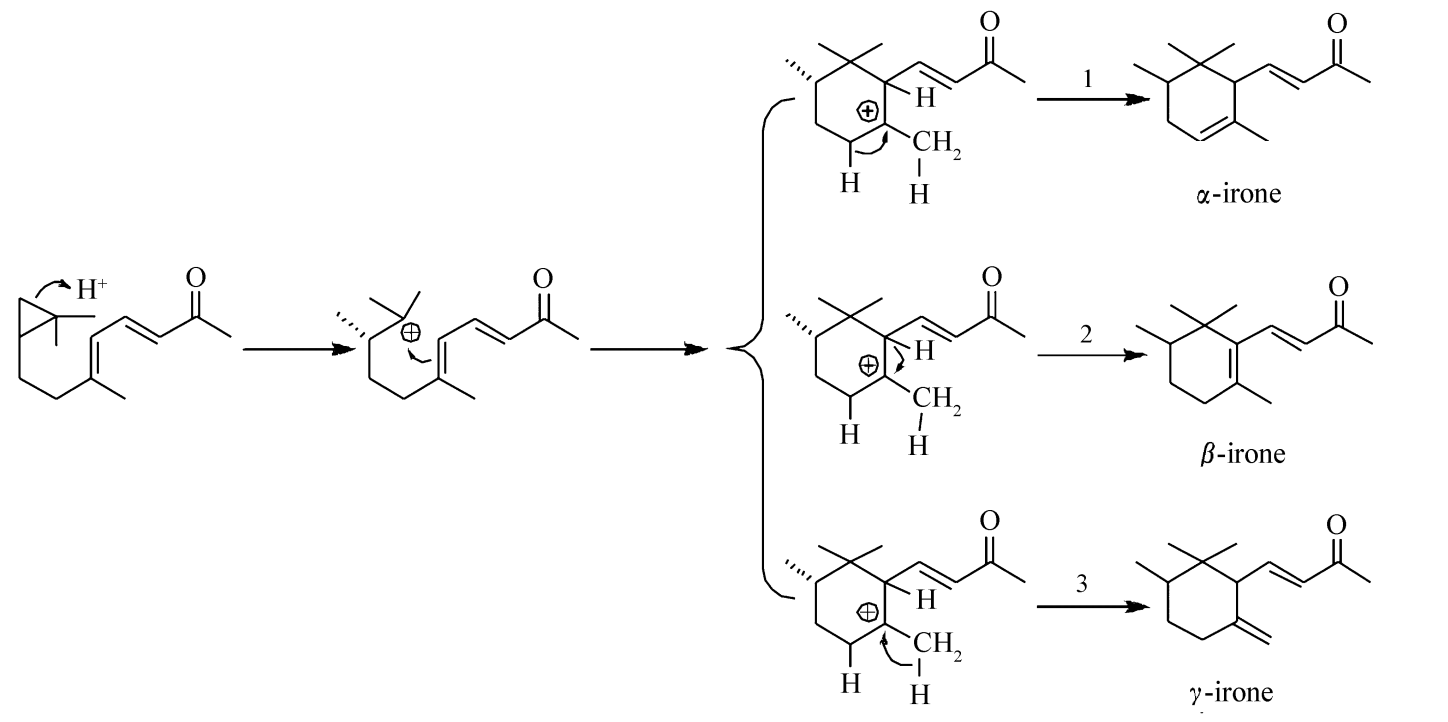
图2 鸢尾酮合成的关环机理[1]
鸢尾酮合成中关环反应机理如图2所示,反应步骤分为3步:第一步三元环吸收H+,使三元环开环形成叔碳正离子;第二步共轭双键与叔碳正离子结合,关环形成六元环;第三步脱H+反应形成新的双键得到3种鸢尾酮产物。最后一步脱H+反应有3个反应方向,按方向1脱H+,脱去的是一个位阻较小的仲氢原子,由于氢原子正好处于碳正离子的反向位置,反应所需活化能最低,反应速度快,得到的是隔离型烯烃结构产物(α-鸢尾酮),产物的内能相对较高,通常称为动力学控制反应。实验结果反应温度低和反应初期时α-鸢尾酮含量高可以证实此结论。按方向2脱H+,脱去的是一个位阻较大的叔氢原子,虽然叔氢原子反应活性最大,但是,由于叔氢原子正好处于碳正离子的同向位置,导致反应所需活化能较高(消去反应为反向消去),反应速度慢,得到的是共轭型烯烃结构产物(β-鸢尾酮),产物的内能最低,通常称为热力学控制反应。实验结果反应温度升高和反应时间延长时,α-鸢尾酮含量降低,β-鸢尾酮含量升高可以证实此结论。按方向3脱H+,脱去的是一个伯氢原子,伯氢原子反应活性低,反应所需活化能最高,反应速度最慢,得到是环外烯烃结构产物(γ-鸢尾酮),产物的内能最高,其所占比例最小。每批次鸢尾酮产品中,γ-鸢尾酮含量基本上在8%左右可以证实此结论。综上所述,低温关环的主要产物是α-鸢尾酮,高温关环的主要产物是β-鸢尾酮,反应时间延长,α-鸢尾酮转化为β-鸢尾酮。所以,反应温度和反应时间可以决定α-鸢尾酮和β-鸢尾酮的比例,关环反应合成鸢尾酮应该在低温下快速进行反应,以提高α-鸢尾酮的选择性。
2、鸢尾生香菌的分离鉴定及鸢尾酮的生物合成
南海珍等针对传统植物提取法生产鸢尾酮过程中存在的生产周期长、产物得率低、生产成本高等问题,提出以新鲜根粉为原料利用微生物发酵生产鸢尾酮的方法。从鸢尾根茎中筛选得到一株产香细菌,通过细菌16S rDNA基因序列分析确定为简单芽孢杆菌(Bacillus simplex strain)。使用甘油混合培养基,添加终浓度5 g·L-1的新鲜根粉为底物,在28℃,200 r·min-1条件下,发酵24 h顺式α-鸢尾酮摇瓶产量达到315.95 mg·kg-1。10 L发酵罐放大培养结果表明18 h后顺式α-鸢尾酮产量最高可达到1 037.65 mg·kg-1,是摇瓶发酵产量的3.28倍。利用微生物发酵生产鸢尾酮,大幅度提高了鸢尾酮的生产效率,对促进鸢尾酮生物合成的工业化应用具有重要意义。
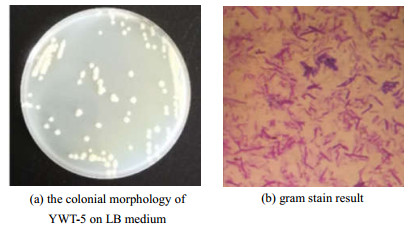
图3 YWT-5菌株的形态特征
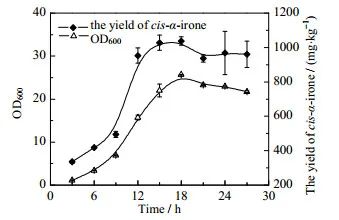
图4 菌体生长曲线及顺式α-鸢尾酮的产量
在10 L发酵罐中进行分批发酵,发酵过程中菌体的生长曲线及鸢尾酮产量变化如图 4所示。当6 h之后,菌体生物量显著增加,进入对数生长期,发酵18 h时OD达到最大值25.67,18 h后菌体量缓慢降低。发酵过程中顺式α-鸢尾酮的产量呈现出先上升后缓慢降低的趋势,0~9 h产量缓慢增加,9~15 h菌体对数生长期内顺式α-鸢尾酮的产量增加迅速,15~18 h产量保持相对稳定。18 h后随着菌体生长进入稳定期直至衰退期,顺式α-鸢尾酮产量也缓慢降低。发酵过程中根粉添加量为5 g·L-1,发酵18 h时顺式α-鸢尾酮产量最高,可达到1 037.65 mg·kg-1,是相同根粉添加量时摇瓶发酵产量(315.95 mg·kg-1)的3.28倍。
四、用途
酮类合成香料。是优良的紫罗兰香料,用作高级调合香料,可为食品用花茶调配香料,最常用于香水、冷霜等化妆品及香皂等。GB 2760--1996规定为允许使用的食品用香料。可代替鸢尾凝脂或其浸膏用于鸢尾、紫罗兰、桂花及高档香精配方,能提调香气,取得甜香。由于味觉为非常有力的甜,适当稀释有浆果样香味,故可用于浆果、果香等食用香精。
五、鸢尾酮的药理活性
1、伊拉克库尔德斯坦地区鸢尾属植物化学、生物活性及传统植物鸢尾酚类成分研究
12种鸢尾属植物(鸢尾科)被认为是库尔德斯坦的传统疗法,特别是用于治疗炎症。植物化学研究仍然很少。本文的第一部分综述了文献中报道的关于库尔德斯坦生长的鸢尾物种的信息,尽管除了鸢尾外,还对库尔德斯坦不同国家收集的植物样本进行了调查。在第二部分中,我们首次对库尔德斯坦地区的鸢尾地上部分和根茎中甲醇提取物的含量进行了研究。两种提取物均表现出明显的剂量依赖性自由基清除和总抗氧化活性,与抗坏血酸的活性相当。中压液相色谱分离得到1 -色氨酸、雄激素、异牡荆素、当药黄素和2″-O-α-1-鼠李吡喃糖基当药黄素,而ε-白藜芦醇二聚体、反-白藜芦醇 3,4 '-氧-二-β-d-吡喃葡萄糖苷和异鸢尾苷元从根状茎中分离得到。这是首次发现鸢尾属植物的最后三种代谢物。分离化合物的各种显著的生物活性科学地维持了鸢尾作为一种药用植物的传统使用。[3]

图5 Iris postii和采集植物的Korek山(him.a拍摄)[3]
2、双色鸢尾科的挥发性成分及其抗菌活性研究
双色野鸢尾(Dietes bicolor, Steud.)的叶、花和根茎中的挥发油采用GLC/FID和GLC/MS进行了分析。从花、叶和根茎中共鉴定出84个化合物,分别占94.65、95.63和87.09%。匙叶桉油烯醇(Spathulenol)(48.44%)为叶油的主要成分,其次为二氢依杜兰(edulan I)(6.25%)、库贝醇(cubenol)(6.00%)和τ-米萜烯醇(cadinol)(5.90%)。花油和根茎油以脂肪酸及其酯类、脂肪烃类及其衍生物为主。采用微肉汤稀释法研究了叶油和花油对四种细菌和四种真菌的抑菌活性。叶油对大部分细菌和真菌的抑菌活性均高于花油,对革兰氏阳性菌的MIC值分别为115 μg/ml和460 μg/ml。革兰氏阴性菌对两种油对大肠杆菌的敏感性较低(MIC > 2 mg/ml),对铜绿假单胞菌完全无效。叶油对白地霉和总状共头霉的MIC值分别为115 μg/ml和920 μg/ml。[4]
3、德国鸢尾的植物化学及治疗潜力研究进展
德国鸢尾(Iris germanica L.)是一种药用植物,具有悠久的使用历史,主要在中世纪的波斯和世界上许多地方用于管理各种各样的疾病。在本研究中,我们旨在综述德国鸢尾植物化学和药理特性外的民族药理学应用。在许多国家如中国、巴基斯坦、印度、伊朗和土耳其,都报告了德国鸢尾的民族医学用途。德国鸢尾的药用部分为根茎和根。根据植物化学研究,不同的生物活性化合物,包括黄酮类化合物,三萜,甾醇,酚,神经酰胺和苯醌,已确定其药用部分。目前药理研究表明,该植物具有多种生物学和治疗作用,包括神经保护、降血糖、降血脂、抗菌、抗氧化、抗增殖、抗炎、抗疟原虫、抗真菌、免疫调节、细胞毒性和抗诱变作用。尽管大多数临床前研究报告了这种植物的各种药理活性,但是,目前还没有足够的临床试验。因此,要对德国鸢尾及其生物活性化合物的疗效和治疗作用得出明确的结论,还需要进一步的临床和实验研究。此外,有必要加强德国鸢尾提取物的药代动力学和安全性研究。[5]

图6 德国鸢尾全株(A),花(B)和药用部位(C) [5]
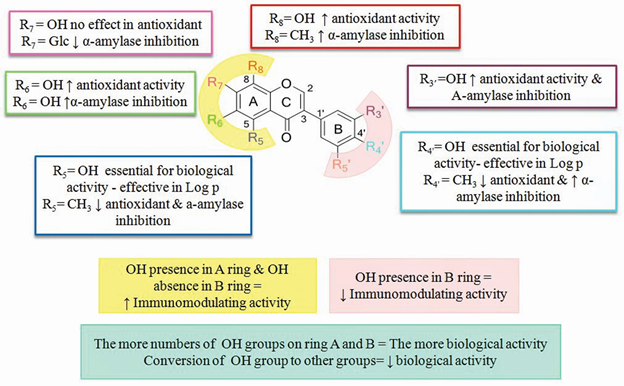
图7 异黄酮的结构和官能团的位置 [5]
4、鸢尾属植物中异黄酮的药理学和植物化学研究
鸢尾是鸢尾科中最大、最复杂的属。鸢尾主要被用作观赏植物,因为它们色彩鲜艳的花朵,或者在香水工业中,因为它们有紫罗兰般的香味,但世界上许多地方也使用许多鸢尾品种作为药用植物来治疗广泛的疾病。对各种鸢尾植物的植物化学研究,已分离出多种次生代谢物。鸢尾属植物中已有近200种化合物被报道,包括黄酮类化合物、异黄酮及其苷类化合物、苯醌类化合物、三萜类化合物和二苯乙烯类化合物。本属植物含有丰富的异黄酮类化合物,具有广泛的生物活性,包括抗炎、抗氧化和抗癌化学预防特性。目前的植物化学和药理学研究为鸢尾属植物的根、叶和花的化学成分及其可能的药理和药用价值带来了新的认识。本文综述了鸢尾在过去几十年的研究结果,把异黄酮的分离及其相关药理活动的信息放在一起。这些综述还表明,食用富含异黄酮的饮食和减少各种疾病如癌症、心血管疾病和骨质疏松症,以及降低对细菌和病毒感染的可能性具有直接益处。[6]
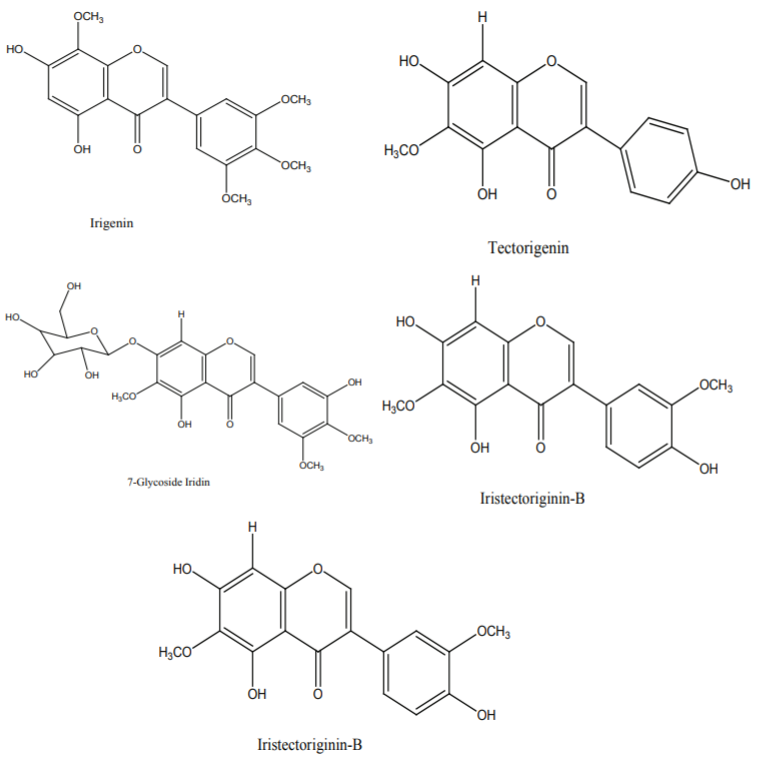
图8 不同鸢尾属植物异黄酮的结构 [6]
异黄酮的苯基连着3号位,而黄酮类化合物的苯基连着2号位。这些异黄酮主要出现在豆科植物中(特别是凤蝶亚科),尽管文献显示,含有这些化学成分的许多其他植物也存在于其他植物科中,如菊科、鸢尾科、肉豆蔻科和蔷薇科。这些异黄酮可以作为类固醇模拟物,填补了立体化学空间可能被雌激素化合物占据。正是这种特殊的化学作用,有助于解释许多营养草药补充剂和外用制剂的效果。图9为ER受体中的大豆苷元。[6]
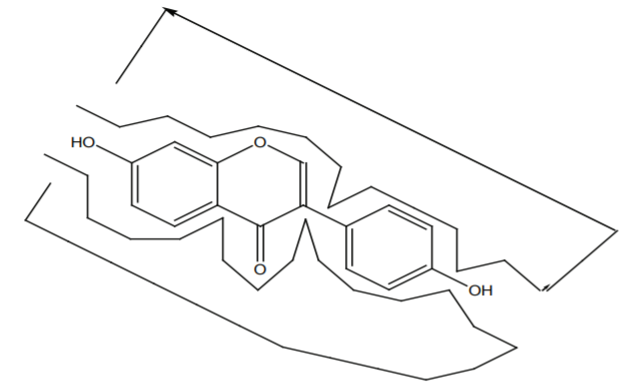
图9 ER受体活性部位的大豆苷元 [6]
7、黄鸢尾(iris pseudacorus L.):化学成分及药理作用
不同种类的鸢尾长期用于医学。黄鸢尾(iris pseudacorus L.)在俄罗斯广泛分布。对这种植物的化学成分已作了相当深入的研究。黄鸢尾中含有黄酮类、香豆素类、单宁类、氧杂蒽酮类、皂苷类、萜类,包括鸢尾酮类、多糖、氨基酸等。这种植物的矿物成分也被测定过。黄鸢尾根状茎在民间医学中被广泛用作祛痰、抗菌、利尿、治疗烧伤、愈合、止血、收敛和抗寄生虫剂。这种植物的广泛应用显然是由于其丰富的化学成分。一些药理作用(抗菌、利尿、抗寄生虫和抗肿瘤活性)得到了实验证实。然而,M.N. Zdrenko提出了黄鸢尾根状茎在俄罗斯药用植物药中只有一个组分的草药配方设计(他们制备了液体混合物No.1)。植物的丰富的代谢组学及其在民间医学表明,长期使用黄色的鸢尾根状茎是有前途的植物制药生产物质创新药物的重要来源。[7]
8. 白花鸢尾(Iris pallid)的医学意义综述
白花鸢尾(鸢尾科)传统上用于止痉、通便、芳香、稀释、驱魔、解毒、利尿、催吐、刺激、祛痰、固定、通便、胸、泻和镇静。它含有油脂、芳香族成分、树脂、大量淀粉、粘液质、酚类、黄酮类和糖苷。白花鸢尾具有抗炎、抗氧化、抗衰老、抗癌、抗寄生虫和抗菌等多种药理作用。现就白花鸢尾的化学成分及药理作用作一综述。
参考文献
[1] 胡铁,皮少峰, 王烨, 高海丽,孙汉洲, 黎继烈.关环反应合成鸢尾酮. 应用化学, 2014, 31(11): 1297-1301.
[2] 南海珍, 黄磊, 蔡谨, 徐志南. 鸢尾生香菌的分离鉴定及鸢尾酮的生物合成[J]. 高校化学工程学报, 2020, 34(1): 149-156. DOI: 10.3969/j.issn.1003-9015.2020.01.019.
[3] Amin HIM, Hussain FHS, Najmaldin SK, Thu ZM, Ibrahim MF, Gilardoni G, Vidari G. Phytochemistry and Biological Activities of Iris Species Growing in Iraqi Kurdistan and Phenolic Constituents of the Traditional Plant Iris postii. Molecules. 2021; 26(2):264. https://doi.org/10.3390/molecules26020264
[4] Ayoub, Iriny M., Youssef, Fadia S., El-Shazly, Mohamed, Ashour, Mohamed L., Singab, Abdel Nasser B. and Wink, Michael. "Volatile constituents of Dietes bicolor (Iridaceae) and their antimicrobial activity" Zeitschrift für Naturforschung C, vol. 70, no. 7-8, 2015, pp. 217-225. https://doi.org/10.1515/znc-2015-0164
[5] Bahareh Sadat Yousefsani, Motahareh Boozari, Kobra Shirani, Amirhossein Jamshidi, Majid Dadmehr, A review on phytochemical and therapeutic potential of Iris germanica, Journal of Pharmacy and Pharmacology, Volume 73, Issue 5, May 2021, Pages 611–625, https://doi.org/10.1093/jpp/rgab008
[6] Disha C, Afroze A. Pharmacology and Phytochemistry of Isoflavonoids from Iris Species. J of Pharmacol & Clin Res. 2017; 3(2): 555609. DOI: 10.19080/JPCR.2017.03.555609
[7] E.A.Tikhomirova; A.A. Sorokina, I.M. Sechenov. YELLOW IRIS (IRIS PSEUDACORUS L.):CHEMICAL COMPOSITION AND PHARMACOLOGICAL EFFECTS. Pharmacy, 2018,(2) DOI: https://doi.org/10.29296/25419218-2018-02-02
[8] Al-Snafi, Ali. (2021). The medical importance of Iris pallida -A review. International Journal of Biological and Pharmaceutical Sciences Archive. 1. 10.30574/ijbpsa.2021.1.2.0046.