服务热线
177-5061-9273

诺卡酮,又称圆柚酮,英文名Nootkatone,是一种天然有机化合物,是一种倍半萜类化合物,也是一种酮,是葡萄柚中最重要最昂贵的芳香物质,它也存在于其他生物体中。

诺卡酮赋予葡萄柚特有的柑橘味
以前,诺卡酮被认为是葡萄柚气味和味道的主要化学成分之一。在高纯度的情况下,它通常是无色的晶体。原油是液体,粘稠,呈黄色。诺卡酮通常是通过化合或生化氧化从葡萄柚中提取的。在阿拉斯加黄杉树和香根草中都有发现。

诺卡酮的天然来源
诺卡酮是从柚子皮油和阿拉斯加黄柏油中分离出的。这个物种的名字,nootkatensis,来源于加拿大nuu - cha - nulth人的语言(以前被称为Nootka人)。
诺卡酮的基本性质及用途
无色或淡黄色油状液体。纯品熔点35~36℃,+185°~+186°。具持久而强的柑橘样果香,在较低稀释度时呈典型的柚子香气。由具有相似立体结构骨架的巴仑西亚橘烯为原料氧化而得。主要用于配制各种柑橘型香精。
别名:圆柚酮,
其他名称:5,6-二甲基-8-异丙烯基-二环-(4,4,0)-癸-1-烯-3-酮。分子式:C15H22O,相对分子质量:218.34。
理化性质:结晶体,不溶于水,溶于乙醇等有机溶剂,熔点36~37 ℃。
天然存在:柑桔、圆柚中。
香气特征:具有圆柚、柑桔、橙子的气味,并带有甜的果皮、木香香韵。
应用:可用于调配圆柚、橙子、热带水果等食用香精和烟用香精。
在烟气中的作用:具有增加卷烟香气,丰满卷烟香味和降低刺激的作用。
参考用量:在最终加香食品中的建议用量为10 mg/kg。
安全管理情况:FEMA编号为3166,FDA编号为 172.515,CoE编号为 11164,中国GB 2760-1996批准为暂时允许使用的食品香料。

诺卡酮广泛应用于香精和香料行业
从瓦伦烯高效生产诺卡酮
最重要和最昂贵的葡萄柚香味,诺卡酮(2),可以降低体脂率,因此它的高效生产已被化妆品和食品工业部门迫切要求。[1]
此前,从巴伦西亚橙精油中提取的瓦伦烯(1)通过肠杆菌属(Enterobacter sp.)转化为诺卡酮(2)的转化率仅为12%,红球菌(Rodococcus KSM-5706)的转化率为0.5%,和细胞色素P-450 (CYP450)的转化率为20%。诺卡酮(2)由瓦伦烯(1)与AcOOCMe3和低产量铬酸在三步法化学合成,使用表面官能化二氧化硅,由金属催化剂,如Co2+和Mn2+与叔丁基过氧化氢可获得75%的产。但这些合成方法并不安全,因为它们涉及有毒的重金属。因此,设计一种不使用任何铬、锰等重金属的环境友好的诺卡酮合成方法迫在眉睫。从巴伦西亚橙油中得到的商业上可获得的廉价倍半萜烃(+)-valencene(1)通过小球藻(Chlorella)、毛霉菌(Mucor)、葡萄座腔菌(Botryosphaeria dothidea)和可可球二孢菌(Botryodiplodia theobromae)的生物转化可有效地合成诺卡酮(2)。[1]
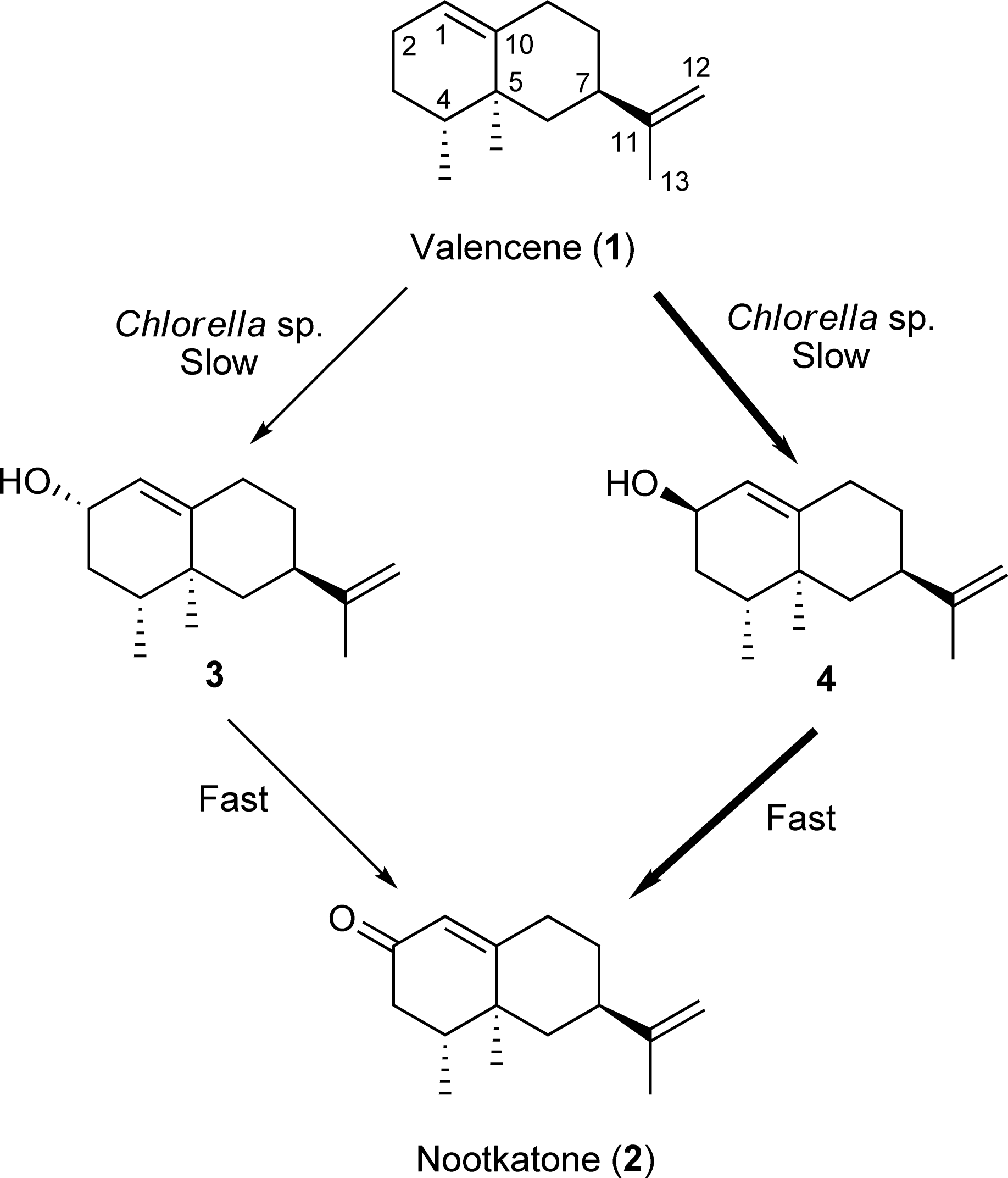
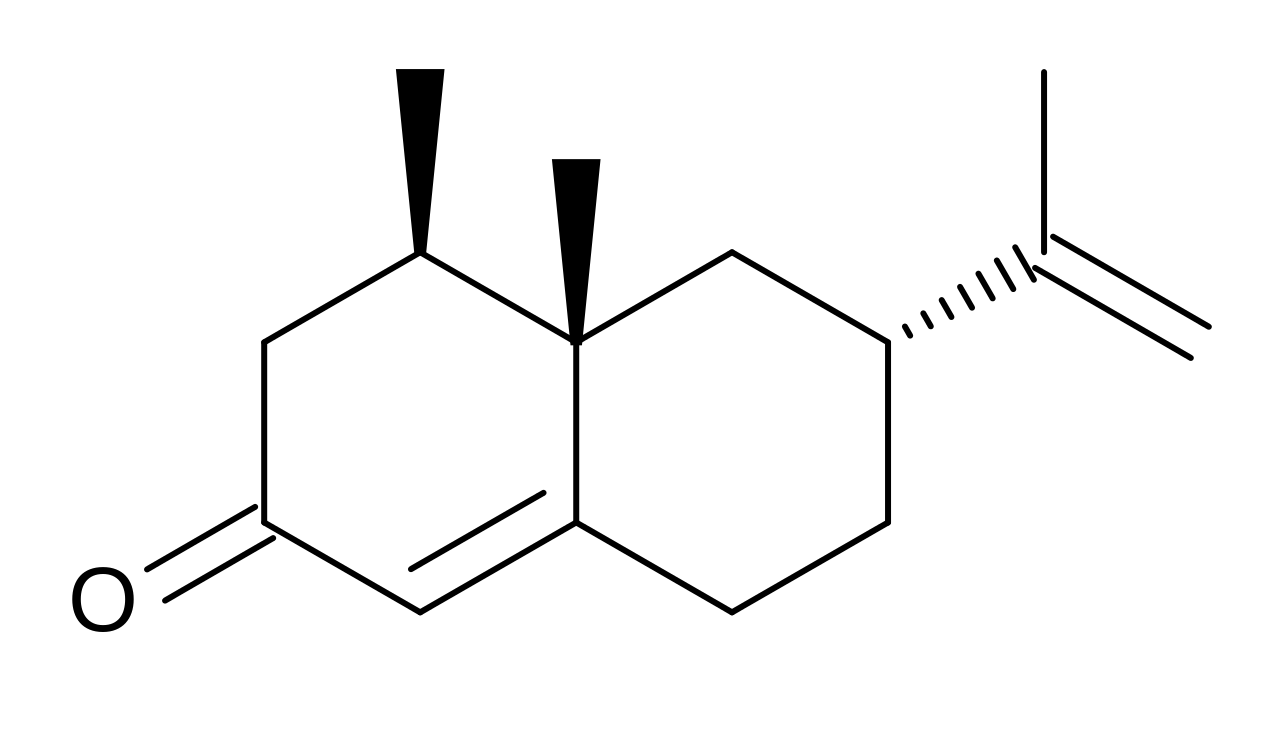
图1 小球藻对瓦伦烯(1)的生物转化[1]
将淡色小球藻(Chlorella fusca var. vacuolata)IAMC-28接种于Noro培养基,光照固定培养。利用蔡贝克氏(czapek)-蛋白胨培养基对纤维素曲霉(Aspergillus cellulosae)、黑曲霉(A. niger)、葡萄座腔菌(B. dothidea)、可可球二孢菌(B. theobromae)、黄色镰孢菌(Fusarium culmorum)和毛霉(Mucor)进行底物的生物转化。Yoshiaki Noma实验室从大阪府土壤中分离得到黑曲霉,并根据其生理形态特征进行鉴定。(+)-Valencene (1) (20 mg 50 ml)从巴伦西亚橙精油中分离出来,加入培养基中,由淡色小球藻(C. fusca)进一步转化18天,产生诺卡酮(GC-MS峰面积:89%;分离的收率:63%)。由NaBH4和CeCl3还原2可以得到2α-羟基瓦伦烯(3),其得率为87%,然后与对硝基苯酸(p-nitrobenzoic acid),三苯基膦( triphenylphosphine),偶氮二甲酸二乙酯( diethyl azodicarboxylate)进行光延反应(Mitsunobu reaction),以合成从姜科植物益智(Alpinia oxyphylla)中分离得到具有钙拮抗作用的诺卡酮(2β-羟基瓦伦烯)(4),其得率为42%。[1]
这样得到的化合物3和4很容易被淡色小球藻(C. fusca)和蛋白核小球藻(C. pyrenoidosa)生物转化,只需1天就能得到高产量(80-90%)的诺卡酮(2)。化合物1的生物转化进一步由蛋白核小球藻(C. pyrenoidosa)和普通小球藻(C. vulgaris)以及土壤细菌进行,得到了较高的诺卡酮产量。在蛋白核小球藻(C. pyrenoidosa)对1进行生物转化的时间过程中,在没有2α-羟基瓦伦烯(3)的情况下,诺卡酮(2)和诺卡醇(4)的产量随着化合物1产量的减少而增加,随后2的产量随着3产量的减少而增加。在瓦伦烯(1)的代谢途径中,1缓慢转化为诺卡醇(4),随后4迅速转化为2,如图1所示。[1]
从土壤中分离出来的真菌菌株毛霉菌(Mucor sp.)被接种在蔡贝克氏(czapek)-蛋白胨培养基(pH7.0)中,在30℃下静态培养7天,发现粘附在叶状苔类苍白球亚纤毛(Thalloid liverwort Pallavicinia subcilita)上。将化合物1(20毫克50毫升)加入培养基中,再培养7天。这导致了诺卡酮(2)的高产量(82%)。[1]
还使用从导致各种水果腐败的真菌中分离出来的植物病原真菌葡萄座腔菌(B. dothidea)和可可球二孢菌(B. theobromae)(共31个菌株),对1到2的生物转化进行了研究。同样浓度的底物1与葡萄座腔菌(B. dothidea)和可可球二孢菌(B. theobromae)一起培养,得到诺卡酮(42-84%)。[1]
用于化妆品和食品工业的昂贵的柚子香味的诺卡酮(2)是通过(+)-瓦伦烯(valencene)(1)的生物转化大量获得的,这种香原料可以由小球藻、真菌如毛霉菌、葡萄座腔菌和可可球二孢菌从瓦伦西亚橙廉价获得。这是一个非常廉价和清洁的氧化反应,不使用任何重金属,因此这种方法有望在诺卡酮的工业生产中找到应用。[1]
诺卡酮的应用
喷雾形式的诺卡酮已被证明是对付鹿蜱和孤星蜱的有效驱虫剂或杀虫剂。它也是一种对付蚊子的有效驱蚊剂或杀虫剂,还可以驱除臭虫、头虱和其他昆虫它是一种环境友好型杀虫剂,因为它是一种挥发性精油,在环境中不持久。美国环保局于2020年8月10日批准了它的这种用途。与香茅、薄荷油和柠檬草油等植物精油驱蚊剂相比,它驱蚊的能力可以持续几个小时,它对人体无毒,是一种经批准的食品添加剂,通常用于食品、化妆品和药品。

保护自己和家人免受蚊虫和蜱虫叮咬的最好方法是使用驱虫剂

埃及伊蚊传播的病毒包括登革热、寨卡、奇昆古尼亚热和黄热病

黑脚蜱可以传播多达7种病原体,包括导致莱姆病的细菌。
美国环保署(EPA)对诺卡酮的注册为企业开发新型驱虫剂铺平了道路。
美国疾病控制与预防中心已经授权两家公司生产一种杀虫剂和一种驱虫剂。加州圣地亚哥的Allylix公司(现为Evolva公司)是这些授权方之一,公司开发了一种酶发酵工艺,该工艺将比以前的工艺更经济有效地生产诺卡酮。
1、诺卡酮:一种用于开发杀虫剂和驱虫剂的新活性成分[2]
诺卡酮,作为EPA注册产品,允许制造商为消费者开发驱虫剂,洗液和肥皂。诺卡酮是:一种在阿拉斯加黄杉树和葡萄柚皮中发现的微量化合物。能够击退和杀死蜱虫和昆虫,包括蚊子。负责柚子特有的香味和口感。广泛用于香精工业制造香水和古龙水。在皮肤和衣服上可以持续几个小时。用于柑橘味的洗发水,护发素,洗液。广泛应用于食品工业中,给食品调味。需要好几吨葡萄柚才能产生1公斤(2.2磅)的诺卡酮。Evolva的工艺允许以高度可重复性和无污染的方式大量生产诺卡酮。曾经稀有而昂贵的诺卡酮现在的生产成本很低。[2]
诺卡酮是一种活性成分,而不是最终用途(品牌名称)产品。有效成分使最终使用的产品有效。例如,避蚊胺(DEET)是许多品牌驱虫剂中使用的活性成分。在EPA注册后,CDC的独家授权合作伙伴Evolva就可以将诺卡酮作为一种活性成分销售给杀虫剂和驱虫剂;涂在皮肤上的驱虫剂,公共卫生用途(非农业用途)的低量和超低量喷雾剂。[2]
诺卡酮有一种新颖的作用方式,诺卡酮似乎以一种独特的方式杀死咬人的害虫,不同于其他已经在EPA注册的杀虫剂。诺卡酮的作用不同于其他杀虫剂,包括拟除虫菊酯、有机磷、氨基甲酸酯和环二烯。用诺卡酮制成的杀虫剂可以帮助消灭对现有蚊子产生抗药性的蚊子。[2]
2、诺卡酮现已在美国环保署注册[3]
由美国疾病控制与预防中心(CDC)发现和开发的一种新的活性成分已被美国环境保护署(EPA)注册用于杀虫剂和驱虫剂。[3]
新的成分,诺卡酮,排斥和杀死蜱虫,蚊子,和各种各样的其他咬人的害虫。诺卡酮负责葡萄柚特有的气味和味道,被广泛用于香水工业,制造香水和古龙水。在阿拉斯加的黄杉树和葡萄柚皮中发现了微量的这种物质。[3]
诺卡酮现在可以用来开发新的驱虫剂和杀虫剂来保护人类和宠物。CDC的授权合作伙伴Evolva正在与领先的虫害控制公司就可能的商业合作进行深入讨论。有意开发品牌消费品的公司将被要求向美国环境保护署提交注册包进行审查,这些产品最早将于2022年上市。[3]
“CDC很自豪能够领导诺卡酮的研究和开发,”Jay C. Butler说,医学博士,传染病副主任。“为现有的预防咬伤方法提供新的替代方法,为解决预防病媒传播疾病的最大挑战之一——预防咬伤铺平了道路。”[3]
研究表明,当诺卡酮被配制成驱虫剂时,它们的保护效果可能与含有其他有效成分的产品相似,可以提供长达数小时的保护。[3]
诺卡酮以一种独特的方式杀死咬人的害虫,不同于其他已经在EPA注册的杀虫剂,包括拟除虫菊酯、有机磷、氨基甲酸酯和环二烯。根据美国环保署的说法,拥有一种新的有效的杀虫剂成分将有助于解决对目前使用的其他产品日益增长的杀虫剂抗性水平。[3]
环保署化学品安全和污染预防办公室助理署长亚历山德拉·达波利托·邓恩(Alexandra Dapolito Dunn)说:“环保署很高兴继续与疾病预防控制中心合作,注册诺卡酮,这是帮助保护美国公众免受昆虫和扁虱叮咬的另一种工具。”“这种新的活性成分有潜力用于未来的驱虫剂和杀虫剂,保护人们免受疾病。在美国的许多地区,蚊子已经对现有的杀虫剂产生了抗药性。我们工具箱中的一种新的活性成分将有助于矢量控制项目。”[3]
蚊子和蜱虫传播的疾病在美国的每个州和地区都是一个日益严重的威胁。从2004年到2018年,报告的蚊媒传播疾病病例数量翻了一番。在美国报告的所有病媒传播疾病病例中,蜱媒传播疾病占了近8 / 10。这些疾病风险的增加意味着对联邦、州和地方卫生部门和病媒控制机构的要求越来越高。[3]
疾控中心从2014年开始与Evolva合作。2017年,Evolva获得生物医学高级研究和开发局(BARDA)合同,主要目标是推进诺卡酮和基于诺卡酮的产品的开发,以预防登革热和寨卡病毒等蚊媒疾病。这项工作得到了美国疾病控制与预防中心联邦基金的支持,并由负责防范和应对的助理国务卿办公室(BARDA)根据第2号合同管理——HHSO100201700015C。[3]
诺卡酮的药理或生物活性
1、非食品生物活性产品(+)-诺卡酮:化学和生物活性[4]
(+)-诺卡酮,首次从阿拉斯加黄杉(Chamaecyparis nootkatensis)的心材中分离出来,是一种非食用的天然倍半萜酮。由于其强烈的葡萄柚香味和广泛的生物活性,(+)-诺卡酮在食品、化妆品、制药和化工行业的需求日益增长。因此,需要结合现有的最新信息,了解(+)-诺卡酮的研究现状,为(+)-诺卡酮及其类似物的进一步发展铺平道路。本文综述了(+)-诺卡酮的植物来源、化学合成、生物合成、结构修饰以及(+)-诺卡酮及其衍生物杀虫活性和其他生理活性的研究进展。我们希望这项工作可以为(+)-诺卡酮及其类似物在食品、化妆品、制药和化工行业的进一步应用提供参考。[4]
2、山姜属益智仁(A. Oxyphylla)及其活性成分诺卡酮对结直肠癌细胞增殖的抑制作用
背景:山姜属益智仁提取物具有广泛的药理活性。然而,益智仁及其活性化合物诺卡酮在结直肠癌中的分子机制尚不清楚。方法:我们的研究旨在研究益智仁及其生物活性化合物诺卡酮在体外抑制肿瘤中的作用。结果:益智仁提取物和诺卡酮对结直肠癌细胞均有抑制增殖作用。益智仁在结直肠癌细胞中表现出抗氧化活性,可能是通过诱导HO-1介导的。此外,在益智仁的存在下,促凋亡蛋白nag1和细胞增殖蛋白cyclin D1的表达分别升高和降低。当检测抗肿瘤活性时,诺卡酮治疗导致菌落和球状形成的减少。相应地,诺卡酮也导致了nag1表达的增加和cyclin D1表达的减少。诺卡酮抑制cyclin D1的机制涉及蛋白水平调控,而诺卡酮在转录水平上增加nag1的表达。除了具有PPARγ结合活性,诺卡酮还能增加EGR-1的表达,最终导致nag1启动子活性的增强。结论:综上所述,诺卡酮是一种具有抗增殖和促凋亡活性的抗肿瘤化合物。[5]
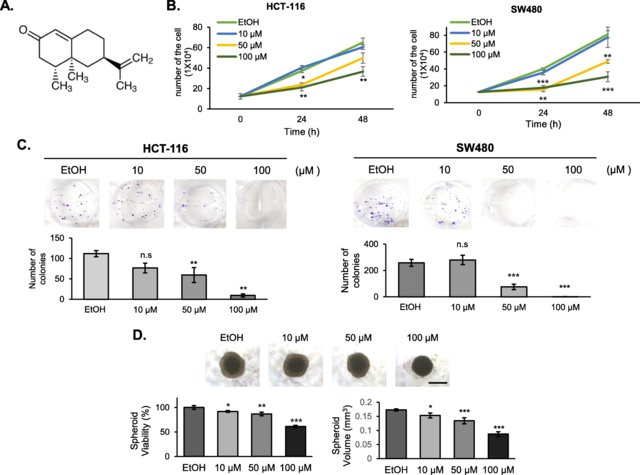
诺卡酮在结直肠癌细胞中显示出抗癌活性。a诺卡酮的结构。b细胞增殖试验。用不同浓度的诺卡酮处理HCT-116和SW480结直肠癌细胞,用血细胞计计数。y轴表示细胞号,x轴表示时间。以乙醇作为诺卡酮的载体。三个独立实验(n = 3)的量化结果以均数±SD表示,*p < 0.05、**p < 0.01、***p < 0.001表示有统计学意义。c菌落形成试验。HCT-116和SW480细胞在含诺卡酮的培养基中生长9天。菌落数被计数并显示在底部的图表中。3个独立实验(n = 3)的结果均以均数±SD表示,*p < 0.05、**p < 0.01、***p < 0.001均有统计学意义。n,不重要。d椭球体活力测定。HCT-116肿瘤球形体用诺卡酮治疗。相位对比图像显示,椭球体的大小,特别是增殖区大小呈剂量依赖性地缩小。比例尺代表500 μm。用CellTiter-Glo®3D细胞活力测定法(Promega)测定球形细胞活力。右图,球体体积计算方法章节描述。该图代表了三个独立的实验。*p < 0.05, **p < 0.01, ***p < 0.001[5]
3、诺卡酮抑制小鼠急性和慢性炎症反应
诺卡酮(NTK)是一种倍半萜类化合物,存在于许多柑橘类植物(芸香科)精油中。考虑到以往的报道表明NTK抑制炎症信号通路,本研究旨在研究该化合物在小鼠急性和慢性炎症模型中的作用。采用角叉菜胶、右旋糖酐、组胺、花生四烯酸所致小鼠足肿胀模型及角叉菜胶所致腹膜炎、胸膜炎观察NTK对急性炎症的影响。用棉球诱导的小鼠肉芽肿模型研究NTK治疗对慢性炎症的影响。在急性炎症模型中,NTK表现出抗水肿作用和抑制白细胞募集,这与血管通透性降低、抑制髓过氧化物酶(MPO)、白细胞介素(IL)1-β和肿瘤坏死因子(TNF)-α的产生有关。在体分析表明,NTZ的抗炎作用也可能是由于抑制环氧化酶(COX)-2活性和拮抗组胺受体1 (H1)。在慢性炎症模型中,这些机制可能有助于肉芽肿重量和匀浆蛋白浓度的降低。综上所述,NTK的抗炎作用与抑制il - 1-β和TNF-α的产生有关,这可能与抑制COX-2活性和拮抗H1受体有关。然而,还需要进一步的研究来确定这种化合物对慢性炎症的作用。[6]
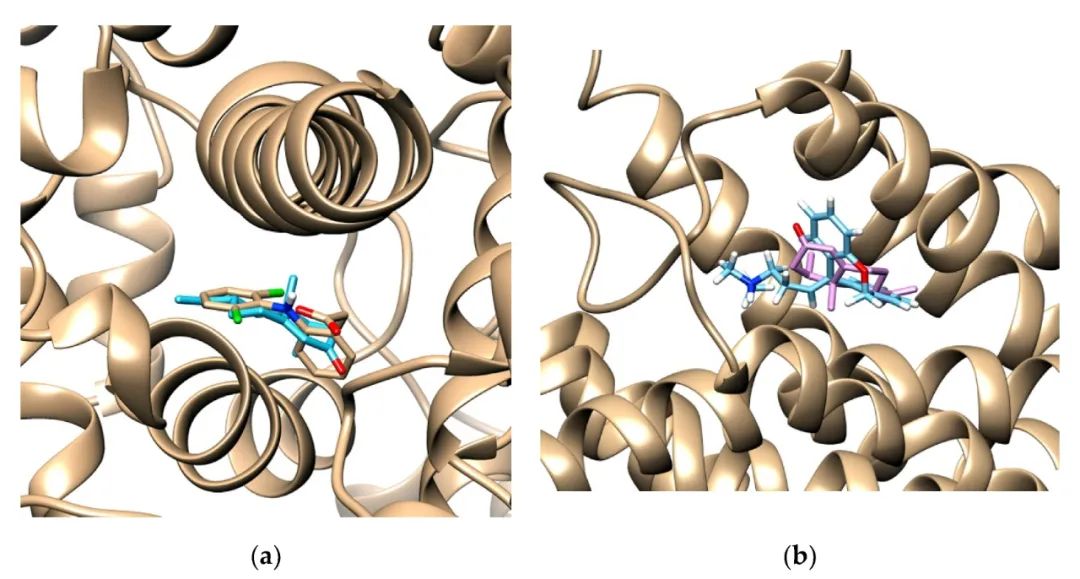
NTK和双氯芬酸结合环氧合酶(COX)-2酶结合位点(a)和NTK和多塞平结合H1受体结合位点(b)的结合最稳定。
4、NQO1通过调节AMPK信号通路介导诺卡酮在脂多糖诱导的神经炎症中的抗炎作用
神经炎症和氧化应激在神经退行性疾病的进展中起关键作用。因此,使用有效的抗炎/抗氧化剂被认为是一种有前途的治疗神经退行性疾病的策略。本实验研究了从葡萄柚中分离的倍半萜化合物诺卡酮(nootkatone, NKT)在体外和体内神经炎症模型中的抗炎和抗氧化作用。在脂多糖(LPS)刺激的BV2小胶质细胞中,NKT抑制iNOS、COX-2和促炎细胞因子的表达,并增加抗炎细胞因子IL-10的表达。此外,NKT抑制活性氧(ROS)的产生,上调抗氧化酶如NQO1和HO-1的表达。分子机制研究表明,NKT抑制lps刺激的BV2细胞中Akt、p38 MAPK和NF-κB的活性,同时增加AMPK、PKA/CREB和Nrf2/ARE信号通路。由于NKT显著增加了NQO1的表达,我们通过药物抑制或敲低实验研究了这种酶的作用。使用NQO1特异性抑制剂双香豆素或NQO1 siRNA处理BV2细胞可显著阻断nkt介导的NO、ROS、TNF-α、IL-1β和IL-10上调。此外,抑制NQO1逆转了NKT对促炎和抗炎信号分子的作用。有趣的是,我们发现AMPK抑制剂化合物C模仿了双香豆素的作用,表明NQO1和AMPK之间存在一种串联。最后,我们发现NKT抑制lps注射小鼠大脑中的小胶质细胞激活、脂质过氧化和促炎标志物的表达,双香豆素也能逆转这一现象。这些数据表明,NQO1通过调节AMPK及其下游信号通路,在介导NKT在lps诱导的神经炎症中的抗炎和抗氧化作用中发挥重要作用。[7]
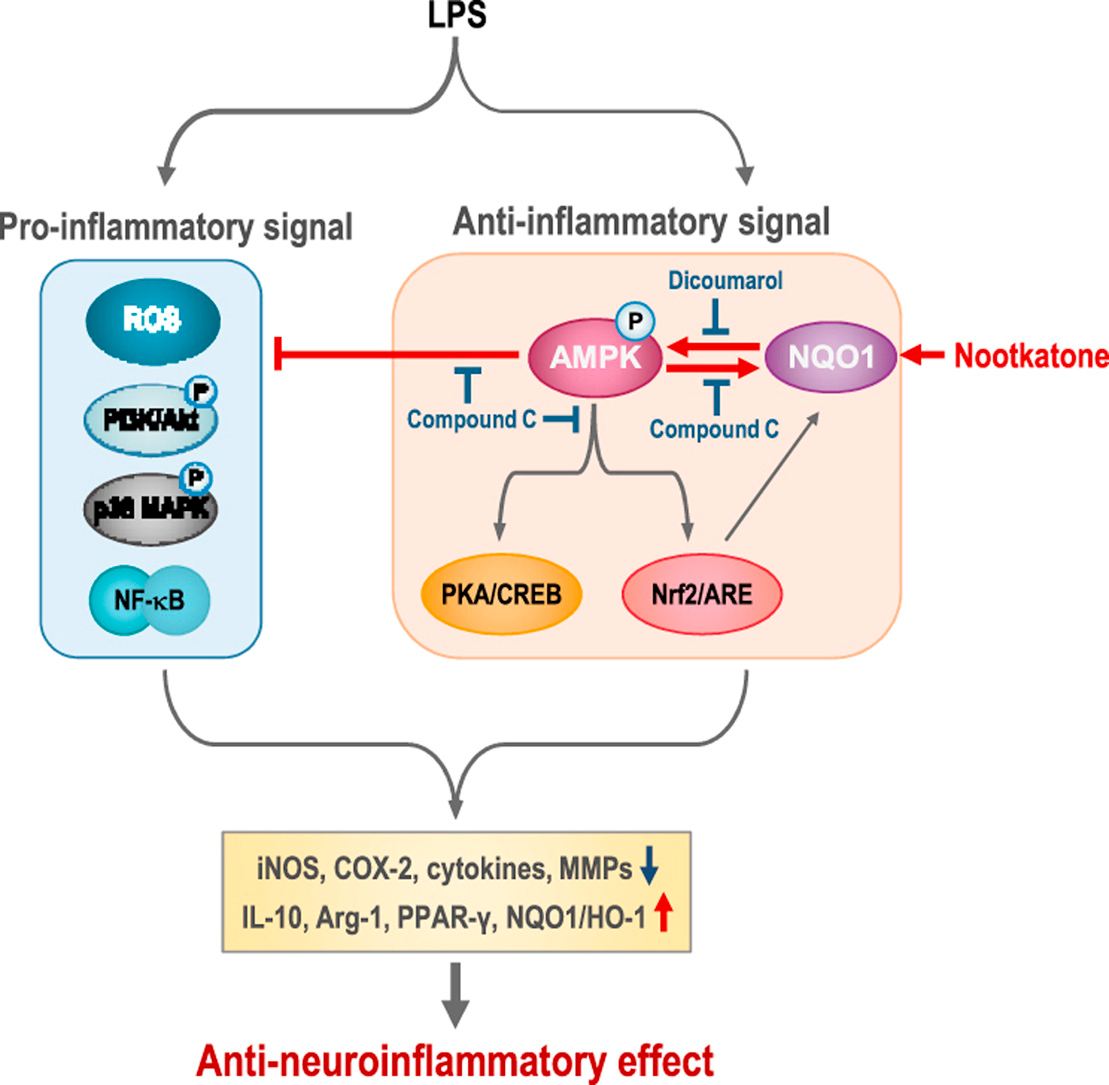
NKT在lps刺激的小胶质细胞中具有抗炎和抗氧化作用。NKT抑制lps注射小鼠大脑中的小胶质细胞激活。NQO1介导NKT在体外和体内的抗炎/抗氧化作用。NQO1-AMPK信号在NKT抗炎机制中起关键作用。NKT在神经退行性疾病的治疗中可能具有治疗潜力。[7]
5、诺卡酮通过抑制氧化应激、炎症和细胞凋亡,在肝纤维化小鼠模型中具有肝保护和抗纤维化作用
本研究以四氯化碳(CCl4)致小鼠肝纤维化为实验材料,研究诺卡酮(NTK)的肝保护和抗纤维化作用。CCl4分别升高血清天门冬氨酸和丙氨酸转氨酶水平。此外,CCl4产生肝脏氧化和硝态应激,其特征是血红素氧合酶-1表达减少,抗氧化防御,4-羟基壬烯醛和3-硝基酪氨酸积累。此外,CCl4诱导肝组织中肿瘤坏死因子-α、单核细胞趋化蛋白-1、白细胞介素-1β等促炎因子的表达,与核因子κB激活密切相关。此外,CCl4处理的动物表现出更高的凋亡,其特征是caspase 3活性增加,DNA碎片化和多聚(adp -核糖)聚合酶激活。此外,组织学和生化检查显示CCl4给药动物的肝脏明显纤维化。然而,NTK处理减轻了CCl4诱导的表型变化。总之,我们的研究结果表明,NTK通过抑制氧化应激、炎症和细胞凋亡发挥肝保护和抗纤维化作用。[8]
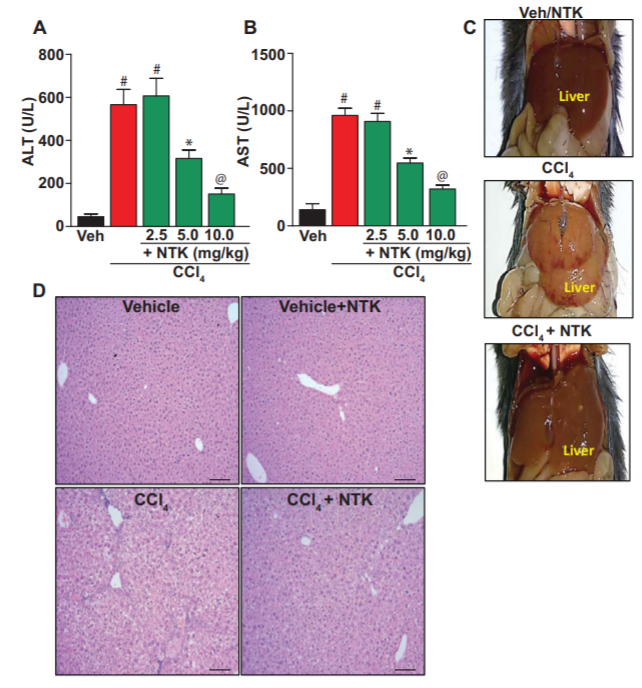
NTK对肝损伤及纤维化的影响。这显示了各组动物血清中ALT (A)和AST (B)的水平。(C)肉眼检查显示CCl4给药小鼠肝纤维化,经NTK减毒。n = 6 /组;#P < 0.0001 vs . Veh;*P < 0.01与CCl4;@P < 0.001 vs . CCl4。(D)分别处理组制备的石蜡包埋肝脏切片具有代表性的苏木精和伊红(H&E)染色。CCl4诱导大结节、纤维间隔、脂肪变性、肝细胞自吸和坏死、炎症细胞浸润。然而,NTK治疗消除了ccl4诱导的肝组织损伤,并保留了组织结构。最后200×放大;比例尺= 50?m. [8]
参考文献:
[1] Yoshinori Asakawa, Yoshiaki Noma,3.20 - Biotransformation of Sesquiterpenoids,Editor(s): Hung-Wen (Ben) Liu, Lew Mander, Comprehensive Natural Products II,Elsevier,2010,Pages 803-892,
ISBN 9780080453828,https://doi.org/10.1016/B978-008045382-8.00066-6.
[2] https://www.cdc.gov/ncezid/dvbd/media/dpk-nootkatone.html
[3] https://www.cdc.gov/media/releases/2020/p0810-nootkatone-registered-epa.html
[4] Jiangping Fan, Zhiyan Liu, Shengnan Xu, Xiaoting Yan, Wanqing Cheng, Ruige Yang, Yong Guo,Non-food bioactive product (+)-nootkatone: Chemistry and biological activities,Industrial Crops and Products,Volume 177,2022,114490,https://doi.org/10.1016/j.indcrop.2021.114490.
[5] Yoo, Eunsu & Lee, Jaehak & Lertpatipanpong, Pattawika & Ryu, Junsun & Kim, Chong-Tai & Park, Eul-Yong & Baek, Seung. (2020). Anti-proliferative activity of A. Oxyphylla and its bioactive constituent nootkatone in colorectal cancer cells. BMC cancer. 20. 881. 10.1186/s12885-020-07379-y.
[6]Bezerra Rodrigues Dantas L, Silva ALM, da Silva Júnior CP, Alcântara IS, Correia de Oliveira MR, Oliveira Brito Pereira Bezerra Martins A, Ribeiro-Filho J, Coutinho HDM, Rocha Santos Passos F, Quintans-Junior LJ, Alencar de Menezes IR, Pezzani R, Vitalini S. Nootkatone Inhibits Acute and Chronic Inflammatory Responses in Mice. Molecules. 2020; 25(9):2181. https://doi.org/10.3390/molecules25092181
[7] Jung-Eun Park, Jin-Sun Park, Yea-Hyun Leem, Do-Yeon Kim, Hee-Sun Kim,NQO1 mediates the anti-inflammatory effects of nootkatone in lipopolysaccharide-induced neuroinflammation by modulating the AMPK signaling pathway,Free Radical Biology and Medicine,164,2021,354-368 doi. 10.1016/j.freeradbio med.2021.01.015.
[8] Kurdi, Amani; Hassan, Kamal; Venkataraman, Balaji; Rajesh, Mohanraj (2017). Nootkatone confers hepatoprotective and anti-fibrotic actions in a murine model of liver fibrosis by suppressing oxidative stress, inflammation, and apoptosis. Journal of Biochemical and Molecular Toxicology, e22017. doi: 10. 1002 / jbt. 22017.