服务热线
177-5061-9273

| 中文名 | γ-壬内酯 |
| 英文名 | gamma-nonanoic lactone |
| 别名 | γ-戊基丁内酯 gamma-壬内酯 α-戊基-γ-丁内酯 alpha-戊基-gama-丁内酯 丙位壬内酯 椰子醛 椰子醛 |
| 英文别名 | nonan-4-olide Nonanolactone Nonalactone, gama- gamma-Nonanolactone γ-Nonalactone 4-Hydroxynonanoic acid gamma-lactone Gamma-Nonalactone COCOUNT ALDEHYDE Aldehyde c18 5-pentyldihydrofuran-2(3H)-one (5S)-5-pentyldihydrofuran-2(3H)-one |
| CAS | 104-61-0 |
| EINECS | 203-219-1 |
| 化学式 | C9H16O2 |
| 分子量 | 156.222 |
| inchi | InChI=1/C9H16O2/c1-2-3-4-5-8-6-7-9(10)11-8/h8H,2-7H2,1H3/t8-/m0/s1 |
| 密度 | 0.956g/cm3 |
| 沸点 | 266.6°C at 760 mmHg |
| 闪点 | 98.8°C |
| 蒸汽压 | 0.00858mmHg at 25°C |
| 折射率 | 1.444 |
| 物化性质 | 无色或淡黄色液体。具有椰子型香气,略有茴香音韵,稀释后有杏、李子香气。 |
| 产品用途 | 用于调配食用香精、饲料香精等 |
| 安全术语 | S22 - 切勿吸入粉尘。 S24/25 - 避免与皮肤和眼睛接触。 |
| 上游原料 | 丙烯酸甲酯 |
椰醛的性质
无色液体,具有强烈的椰子香气。溶于乙醇、丙二醇、乙醚和大多数非挥发性溶剂,不溶于水和甘油。
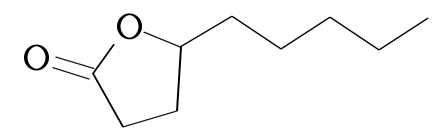
γ-壬内酯的结构式
椰醛的制备
由庚醛与丙二酸反应制得壬烯酸,再内酯化,经萃取、洗涤、蒸馏制得。
椰醛的用途
用作椰子香精的主香剂,还用于调配奶油、杏仁、桃子、樱桃、坚果、热带水果等香精。在烘烤食品中使用量为55 mg/kg;糖果中33 mg/kg;布丁类中28 mg/kg;口香糖中15 mg/kg;冷饮中14mg/kg;软饮料中11 mg/kg。
RIFM香精成分安全评估,γ-壬内酯(γ-nonalactone), CAS注册号104-61-0
RIFM对γ-壬内酯的遗传毒性、重复剂量毒性、发育和生殖毒性、局部呼吸毒性、光毒性/光致敏性、皮肤致敏性和环境安全性进行了评估。数据表明,γ-壬内酯没有遗传毒性。模拟物γ-己内酯(CAS # 695-06-7)的读取数据提供了重复剂量和发育毒性终点的计算MOE >100。使用Cramer Class I材料的TTC评估生殖和局部呼吸毒性终点,γ-壬内酯暴露低于TTC(分别为0.03 mg/kg/天和1.4 mg/天)。来自4-羟基-3-甲基辛酸内酯(CAS # 39212-23-2)和(+/-)3-甲基-γ-癸内酯(CAS # 67663-01-8)的数据表明,在当前声明的使用水平下,γ-壬内酯没有对皮肤致敏的安全问题。根据紫外光谱评价光毒性/光致敏终点;γ-壬内酯并不会引起光毒性/光过敏。对环境终点进行评价;根据IFRA环境标准,γ-壬内酯其风险商数<1,基于其目前在欧洲和北美的使用量(即PEC/PNEC),被认为是对环境友好的化合物。
对映选择性,催化一锅法合成γ-丁内酯基芳香剂
在自然界中,γ-丁内酯核心结构在许多具有多种生物活性的天然产物中被发现,如抗生素、抗肿瘤、抗真菌和细胞抑制特性(图1)。因此,它们也被用作合成的结构单元,但也用于其他不包含这种结构基元的天然产物,例如生物碱或信息素。此外,γ-丁内酯1(见图2)被称为香味和风味分子,使它们不仅适用于制药,也适用于食品工业。
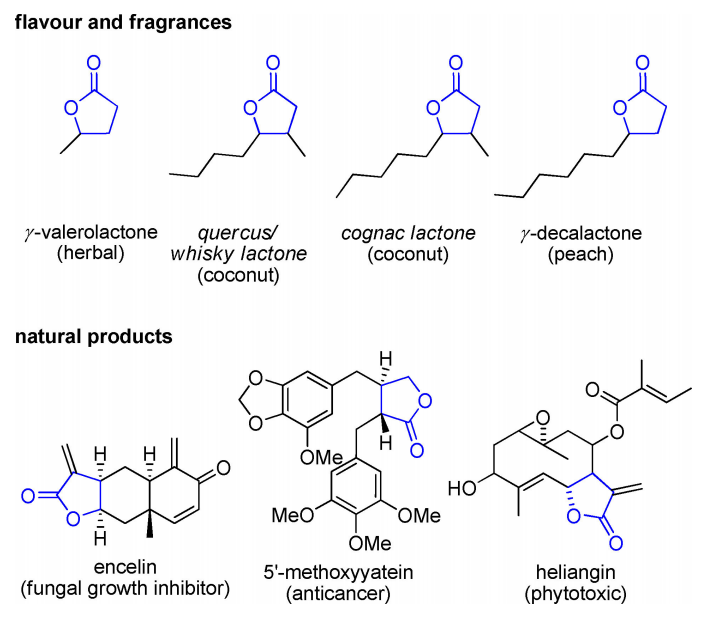
图1 一些以γ-丁内酯为基础的食用香料、日用香料和天然产物的结构
一种常见的γ-丁内酯是栎内酯(quercus lactone)(1c)(图2)。栎内酯(1c)是酒精饮料中的一种风味化合物,是在天然调味过程中从橡树中提取的。因此,它也被称为威士忌内酯(1c)。
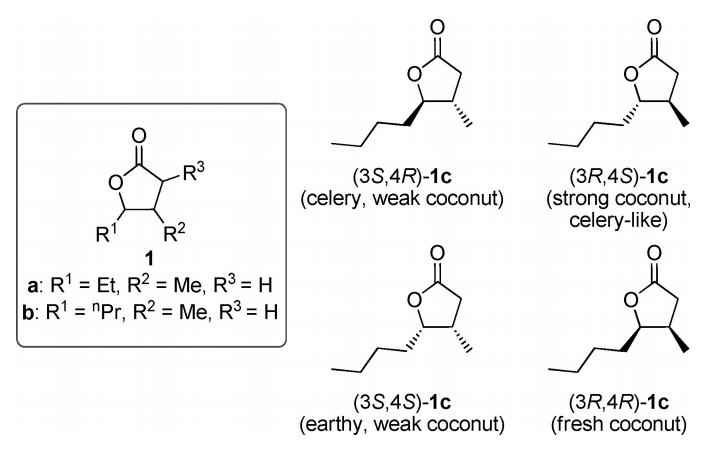
图2 栎内酯的结构
栎内酯(1c)存在的主要橡树树种是美洲栎和法国栎树槲皮雷亚和栎树,但它也在少数的西班牙栎树中发现。Pollnitz等人在文献中描述了某些橡木林中栎内酯(1c)的含量。其中,美国白橡木(quercus alba)中栎内酯的含量最高,其中反式内酯(1c)的含量为6.65µg/g 橡木,顺式内酯(1c)的含量为86.0µg/g 橡木。栎内酯(1c)的天然立体异构体为(3S,4S)-和(3S,4R)-构型。它的味道和气味主要是椰子味,带有泥土味或芹菜味,这取决于内酯的配置。[2]
如方案1所示,α、β-不饱和γ-酮酯2作为化学酶法合成取代γ-丁内酯1的起始原料。采用Horner-Wadsworth-Emmons (HWE)反应直接合成相应底物。经柱层析分离得到的(E/Z)混合物的含量为20-91%。hwe反应和相应的磷酸盐的合成的更多细节在支持信息中描述。这些底物2的一般合成路线及其结构如方案2所示。α,β-不饱和γ-酮酯2的一锅酶法转化包括两个顺序的还原步骤,利用烯还原酶(ER)和醇脱氢酶(ADH)通过中间体4和5,然后是酸催化的内酯化(方案1)。
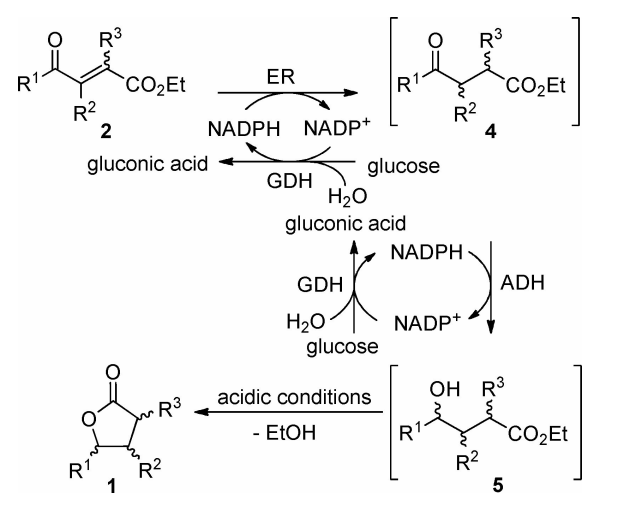
方案1 一锅酶法合成γ-丁内酯
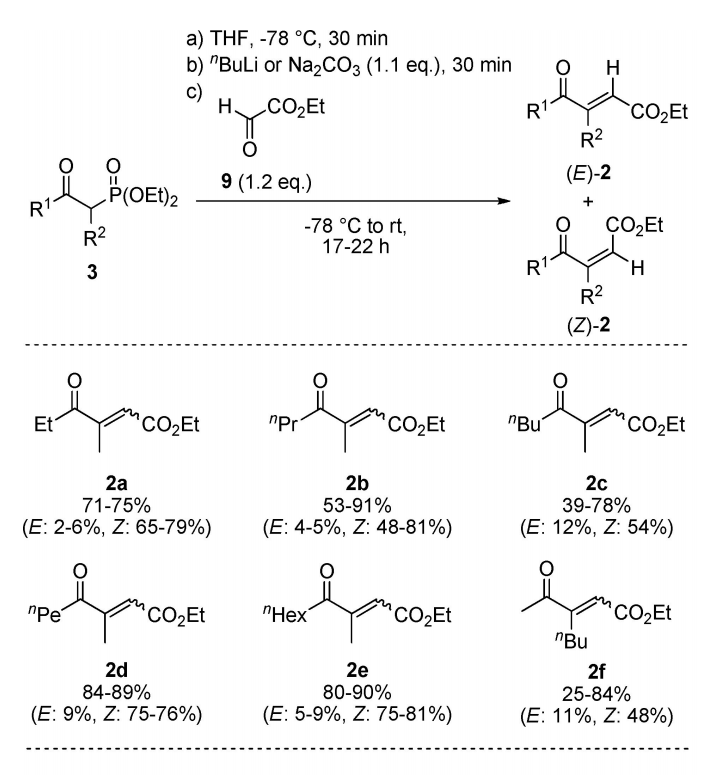
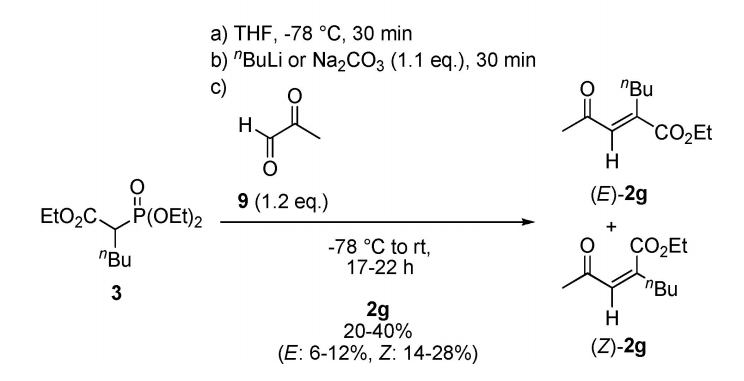
方案2 α,β-不饱和γ-酮酯2的合成路线
γ-壬内酯的风味特性

椰子味,奶油状的,蜡状的,甜奶油状的,油状的,椰子状的,甜的水果味,奶油状的椰子味用途:用于热带水果混合物。
口味:奶油适用于椰子、桃、杏、香草、枫、蜂蜜和巧克力等口味。
椰子奶油:茴芹;椰子;脂肪;适用于:棕色坚果,棕色可可,棕色其他品种,牛奶,香草,水果红色,水果黄色,热带水果,甜的其他品种,酒精。奶油状,开胃,类似椰子和杏子。
γ-壬内酯的药理或生理活性
1、能拮抗可卡因诱导的涡虫运动减弱的烷基γ-内酯的最小结构要求
Baker等最近(2011)报道,天然环内酯(cyclic lactone)、小白菊内酯(parthenolide)和相关类似物可以阻止可卡因在涡虫体内诱导的行为效应的表达,而小白菊内酯的γ-内酯环是这种效应所必需的。在本研究中,我们测试了一系列不同链长(1-8个碳)的烷基γ-内酯,以确定它们对200 μM可卡因诱导的涡虫运动减弱的拮抗能力。含一个4个碳烷基链的γ-内酯不影响涡虫的运动,也不拮抗可卡因引起的运动减弱;只有化合物γ-壬内酯(具有5个碳链长烷基链的γ-内酯)能够防止可卡因诱导的行为模式,而碳链较长的烷基内酯也不能防止可卡因诱导的行为模式。因此,我们认为,在本实验系统中,对抗可卡因作用的化合物家族的最佳结构特征是一个5个碳链长的烷基链γ-内酯环。[3]
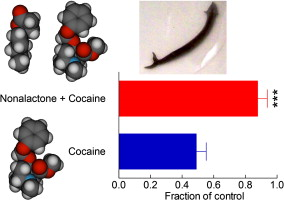
最近,有报道称倍半萜内酯(sesquiterpene lactone ),小白菊内酯(parthenolide)和类似的分子(图3)可以拮抗涡虫属(Dugesia genus)的可卡因诱导行为;此外,在这些研究中,确定了类似于小白菊内酯的分子的γ-内酯部分对其抗可卡因作用至关重要。γ-内酯类化合物在自然界中分布广泛。这些化合物中有许多天然存在于乳制品、水果和坚果等产品中,这些γ-内酯结构被发现有助于它们特有的香味。事实上,这些化合物是烟草产品、香水和一些加工食品的常见添加剂。在目前的工作中,我们测试了一系列不同链长(1 - 8个碳,图1)的烷基γ-内酯对涡虫体内可卡因作用的拮抗能力。
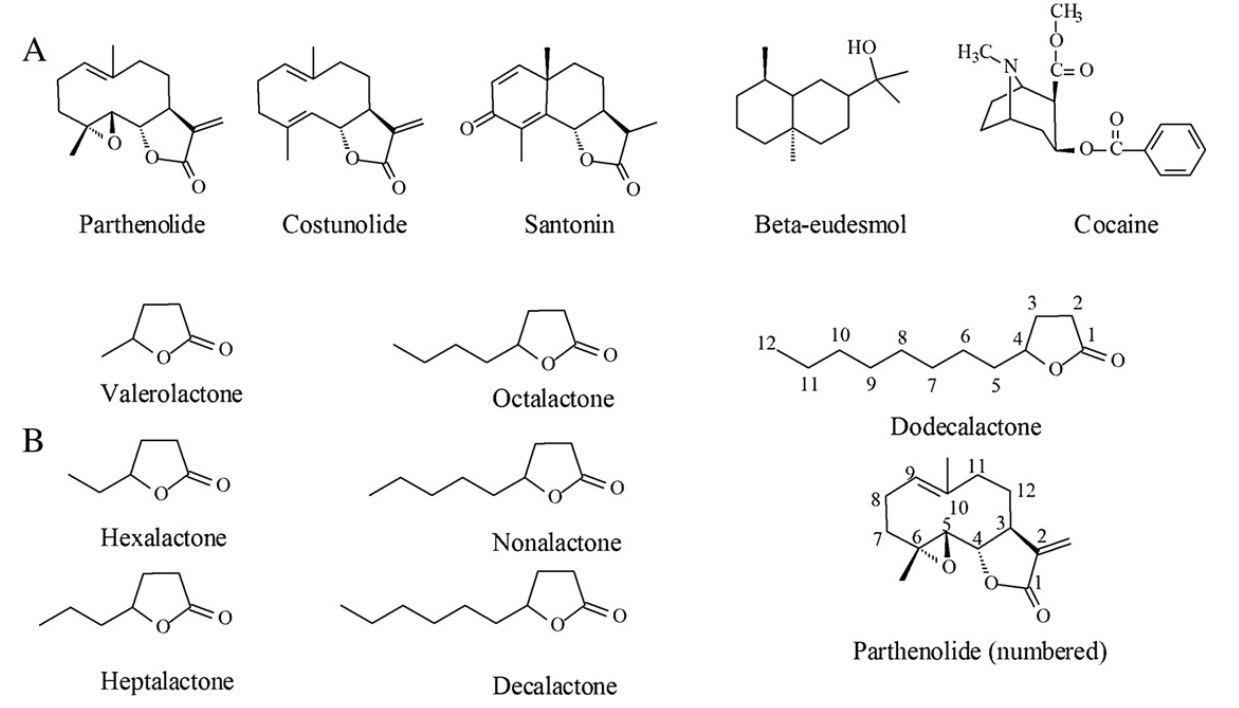
图3 单萜内酯,相关倍半萜和可卡因。B. 本工作中讨论的化合物。为了便于比较,γ-十二内酯和单萜内酯的碳原子被编号(见正文)。
在这项工作中,我们确定了烷基γ-内酯类化合物的最佳结构特征,以对抗可卡因诱导的运动下降的涡虫,是γ-内酯部分,与一个5碳甲基尾连接在内酯环的4位(γ-壬内酯,图3)。这与之前的工作一致,这类化合物中的内酯环在本实验系统中对其可卡因拮抗作用至关重要,然而,我们的结果表明,γ-内酯部分不足以拮抗可卡因作用,因为其他测试的内酯对可卡因都没有活性。我们还确定了γ-壬内酯对可卡因的作用是浓度依赖的,这表明γ-壬内酯和可卡因在涡虫体内竞争一个特定的结合位点,可能是一个蛋白质靶点。根据我们的结果,一个可能证明相关的因素是,在我们的实验中测试的γ-内酯在位置4有一个手性碳原子,正如小白菊内酯和相关化合物所具有的(图3)。在自然界中,γ-内酯主要被发现为4R异构体,然而,4S异构体也被发现。已知γ-内酯部分的手性影响其芳香嗅闻特性。有趣的是,在单萜内酯中4号位置的碳原子是以R形式存在的。我们已经证实,这也适用于广木香内酯(costunolide)和sanantonin(图1),它们对可卡因具有活性,使用分子建模软件如所述。手性可能被证明是γ-内酯/可卡因相互作用的重要因素,特别是当这种相互作用发生在特定的蛋白质位点时,因此本工作的未来方向可能是探索手性对γ-内酯与其可能靶点相互作用的影响。另外两个考虑因素是溶解度和生物利用度问题,这是许多疏水化合物的共同特点。我们通过logP和摩尔溶解度两个参数来估计实验化合物的溶解度来解决这个问题。需要注意的是,测试化合物的实际水溶性将高于指示值,因为使用的实验溶液(APW)含有0.1% (14 mM)的二甲基亚砜(DMSO),这是一种确定的溶解度增强剂。三种较小的化合物(戊基-,己基-和庚基-γ-内酯)在我们的实验机体中不能诱导运动降低;他们也不能对抗所观察到的可卡因效应。然而,这些化合物是最易溶解的。他们的生物利用度在这里没有被确定。另一方面,较大的化合物(辛基-,壬基-,癸基-和十二基-γ-内酯)能诱导涡虫运动减弱,且呈浓度依赖性。有趣的是,在这四种化合物中,只有γ-壬内酯能够拮抗寄生虫体内可卡因的作用;这种缓解依赖于浓度。在辛基、癸基和十二基-γ-内酯的情况下,溶解度和生物利用度不是问题,因为它们都显示出运动减弱效应。我们将我们的数据用以假设在我们的实验系统中可卡因和γ-壬内酯具有共同或重叠的结合位点的证据。烷基链长等于5个碳的γ-内酯本身降低了能动性,但它们对可卡因没有活性,这一事实多少让人想起在某些类型的全麻分子中观察到的切断效应。切断效应是指同源系列化合物(例如正构烷烃或正构烷烃等)的麻醉效力的增加,达到在较高分子量化合物中观察到的麻醉效果下降(甚至完全丧失)的程度。这种效应经常被用来估计蛋白质靶点的分子尺寸,但其他的解释,包括麻醉化合物与膜的相互作用,而不是蛋白质,已被提出。有可能,我们正在观察的机制类似于我们的γ-内酯/可卡因实验中的切断效应。有趣的是,脊椎动物中检测到的最大内酯,十二内酯,是单胺转运体超家族,包括多巴胺转运体(DAT)、血清素转运体(SERT)和去甲肾上腺素转运体(NET)等。可卡因主要与DAT相互作用。利用涡虫S. mediterranea数据库,我们发现了电压门控离子通道和神经递质转运蛋白的同源物。对我们的结果最简单的解释是可卡因与涡虫体内的一个或多个目标蛋白相互作用。其他实验室已经证明,多巴胺能神经元调节涡虫的运动和行为。Nishimura等人(2007)证明,当再生的日本涡虫(Dugesia japonica)中酪氨酸羟化酶(一种合成多巴胺所必需的酶)的表达被抑制时,完全再生的涡虫的正常运动就会减少。此外,在相同的工作中,作者表明,当酪氨酸羟化酶受到抑制时,甲基苯丙胺诱导的多运动也受到抑制。与可卡因一样,甲基苯丙胺抑制多巴胺转运体,尽管机制略有不同。这为进一步研究提供了另一个方向。我们可以使用RNA干扰(RNAi)技术,该技术已成功应用于涡虫研究,以抑制已建立的可卡因靶蛋白的表达,如单胺转运体。利用这些技术,我们可以检测可卡因和本工作中研究的含内酯化合物在涡虫中的作用,这些候选靶蛋白的表达受到抑制,有可能深入了解具体的分子作用机制。
综上所述,γ-内酯类化合物是探索可卡因在生物系统中的作用的新工具。在这项工作中,我们确定了这类化合物的一系列重要的结构特征,这可能证明对设计新的可卡因拮抗剂很重要。此外,我们还提供了额外的证据,证明涡虫在药理研究中作为动物模型的有效性。
2、澳大利亚红葡萄酒中几种4-烷基取代γ-内酯的气味检测阈值及对映体分布
合成了γ-辛内酯(1)、γ-壬内酯(2)、γ-癸内酯(3)和γ-十二内酯(4)的各个对映体。(R)系列的对映体是由L-谷氨酸通过脱氨和还原成(S)-5-氧代-2-四氢呋喃甲醛(S)-7的策略制备的。不同长度的侧链是通过一系列的Wittig反应引入的,所使用的磷化物的选择不同。氢化后得到最终的γ内酯1-4。(S)系列的对映体是以类似的方式从d-谷氨酸开始制备的。通过应用ASTM方法E 679,由25名成员组成的小组,确定了所有8种对映体在 "盒装袋 "干红葡萄酒中的香气检测阈值。确定的最低阈值是(R)-十二内酯(4)的8微克/升,而(R)-壬内酯(2)的最高阈值是285微克/升。除γ-癸内酯(3)外,同一内酯的两种对映体之间的香气检测阈值存在统计学上的显著差异(在5%的水平)。为量化内酯1-4而开发的稳定同位素方法已被扩展到手性相色谱(Rt-betaDEXcst毛细管柱)中使用,可以对单个对映体进行量化。γ-辛内酯(1)和γ-壬内酯(2)在7种酒中的对映体分布以及γ-壬内酯(2)在34种红葡萄酒中的对映体分布被确定;除了少数例外,γ-壬内酯(2)的(R)对映体在分析的干红葡萄酒和贵腐(botrytized)白葡萄酒中比其(S)对映体更为普遍。在贵腐白葡萄酒中,γ-辛内酯(1)的情况也是如此。
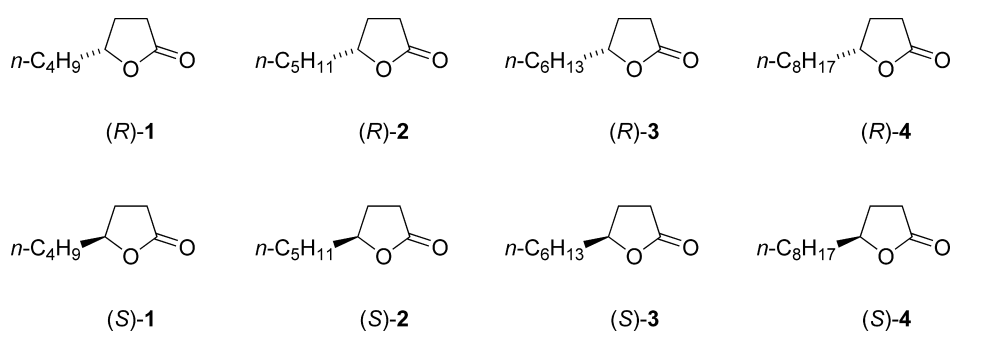
本研究选用了四个烷基取代γ-内酯的(R)和(S)对映体
| 化合物 | 香气描述 |
| R-γ-辛内酯(1) | 椰子味,杏仁味,辛辣绿色 |
| S-γ-辛内酯(1) | 椰子味,脂肪香 |
| R-γ-壬内酯(2) | 柔软的椰子乳脂香,强,甜 |
| S-γ-壬内酯(2) | 脂肪,发霉,弱椰子味 |
| R-γ-癸内酯(3) | 焦糖,脂甜的水果味,柔软的椰子味,浓郁 |
| S-γ-癸内酯(3) | 柔和,甜美的椰子气息,水果脂肪香 |
| R-γ-十二内酯(4) | 芬芳的酒体带有醛和木香的味道,果香浓郁 |
| S-γ-十二内酯(4) | 脂肪果香,奶香 |
参考文献:
[1] Api AM, Belmonte F, Belsito D, Biserta S, Botelho D, Bruze M, Burton GA Jr, Buschmann J, Cancellieri MA, Dagli ML, Date M, Dekant W, Deodhar C, Fryer AD, Gadhia S, Jones L, Joshi K, Lapczynski A, Lavelle M, Liebler DC, Na M, O'Brien D, Patel A, Penning TM, Ritacco G, Rodriguez-Ropero F, Romine J, Sadekar N, Salvito D, Schultz TW, Sipes IG, Sullivan G, Thakkar Y, Tokura Y, Tsang S. RIFM fragrance ingredient safety assessment, γ-nonalactone, CAS Registry Number 104-61-0. Food Chem Toxicol. 2019 Dec;134 Suppl 2:110905. doi: 10.1016/j.fct.2019.110905. Epub 2019 Oct 25. PMID: 31669595.
[2] Kumru, Ceyda; Classen, Thomas; Pietruszka, Joerg (2018). Enantioselective, Catalytic One-Pot Synthesis of γ-Butyrolactone-Based Fragrances. ChemCatChem, 10(21),4917–4926. doi:10.1002/cctc.201801040.
[3] Debra Baker, Sean Deats, Peter Boor, James Pruitt, Oné R. Pagán, Minimal structural requirements of alkyl γ-lactones capable of antagonizing the cocaine-induced motility decrease in planarians, Pharmacology Biochemistry and Behavior,2011,100(1),174-179,doi.10.1016/j.pbb.2011.08.013.
[4] Cooke Née Brown, Rachel C, Katryna A. van Leeuwen, Dimitra L Capone, Richard Gawel, Gordon M. Elsey and Mark A. Sefton. “Odor detection thresholds and enantiomeric distributions of several 4-alkyl substituted gamma-lactones in Australian red wine.” Journal of agricultural and food chemistry 57 6 (2009): 2462-7 .