服务热线
177-5061-9273

中文名称:紫苏醇
中文同义词:紫苏醇;芥子醇;L-紫苏醇;紫苏醇标准品;紫苏醇对照品;紫苏醇25G;紫苏醇、L-紫苏醇、芥子醇、1-羟甲基-4-异丙烯基-1-环己烯
CAS号: 536-59-4
英文名称: Perilla alcohol
英文同义词:perilla; Perillol;(S)-(-)-PeriL;perillalcohol;1-perillalcohol; Perilla alcohol;; Perillic alcohol; 1,8-p-Menthadien-7-ol; L-(-)-Perilly Alcohol
CBNumber: CB0695703
分子式: C10H16O
分子量: 152.23
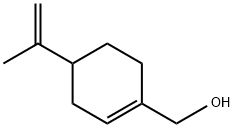
紫苏醇的分子结构式
紫苏醇化学性质
熔点: 271-272°C
沸点: 119-121°C 11mmHg(lit.)
密度: 0.96g/mL at 25°C(lit.)
FEMA: 2664 (p-Mentha-1,8-dien-7-ol)
折射率: n20/D1.501(lit.)
闪点: >230°F
储存条件: Inertatmosphere,2-8°C
酸度系数(pKa):14.85±0.10(Predicted)
JECFA Number: 974
紫苏醇性质、用途与生产工艺
概述
紫苏醇学名4-异丙烯基-1-环己烯甲醇,有似芳樟醇和松油醇味的稠粘油液,存在于姜草油、青柠檬油、杂薰衣草油和留兰香等油中。因具有芳香味道,常被用作食用香精和添加剂的调配剂。紫苏醇作为一种治疗及预防癌症的单萜类药物,在肿瘤如卵巢肿瘤、食道癌、乳腺癌等的治疗方面有独到的治疗效果。
理化性质
粘稠油状液体。有似芳樟醇和松油醇气味。沸点118-121℃ (11×133.322Pa)。相对密度 0.9690。折光率1.4996 ,[α]D-7°。性质稳定, 耐热耐酸, 不易挥发。
合成方法
紫苏醇以游离态或酯的形式天然存在于柑桔、樱桃、薄荷、香柠檬、姜草、杂薰衣草等多种植物中,是植物甲醛、戊酸代谢途径产生的单萜化合物。原则上,紫苏醇可从天然植物精油中单离获得,如Row等采用有机溶剂或超临界CO2萃取提取紫苏醇。虽然紫苏醇存在于多种天然植物精油中,但因含量太低、分离不易而成本过高,因此化学合成紫苏醇就显得尤为重要。有关紫苏醇的合成,大多采用天然存在的单萜化合物为起始原料,经合适的化学转化来进行的。
1、 苧烯氧化法
苧烯是柠檬油、甜橙油、香柠檬油、莳萝油等天然精油的主要成分, 因而其来源是相当丰富的 。从分子结构看, 苧烯与紫苏醇具完全相同的分子骨架结构( 图1) , 在适当的反应条件下, 苧烯可经氧化转化生成紫苏醇。
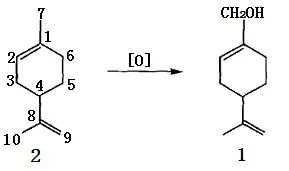
图1 苧烯的分子结构
空气或氧气对苧烯的氧化作用或催化氧化曾有广泛的研究,二氧化硒也可对其进行选择性氧化。但由于苧烯氧化合成紫苏醇是对烯丙位的甲基氢进行氧化,而苧烯分子中有5种不同的烯丙位的氢(如图1所示的3、4、6、7和10位上的氢),因而通常氧化反应的产物十分复杂,紫苏醇的选择率很低。
2、β-蒎烯直接氧化法
Willing等在含有氯化亚铜、苯甲酸铜的乙腈中用过氧化二苯甲酰氧化β-蒎烯,获得主要产物反式香芹醇(产率29.4%)和少量的紫苏醇。夏克坚等采用同样的方法进行β-蒎烯的氧化反应,紫苏醇产率为73%。南京林业大学程芝等用四乙酸铅作氧化剂,β-蒎烯经氧化或氧化酯化、皂化制得紫苏醇,优化条件下紫苏醇收率可达45%。直接氧化法所得紫苏醇产率太低,且产物十分复杂,难以分离提纯,因此应用价值不大。
3、以α-蒎烯为原料合成
以α-蒎烯为原料(4)合成紫苏醇有2种方法,其一是以二氧化硒SeO2为氧化剂在醋酸-醋酐混合溶剂中发生烯丙位选择氧化或氧化-酯化反应,生成桃金娘烯醇(5a)及其乙酸酯(5b),再经异构化、皂化即得1。
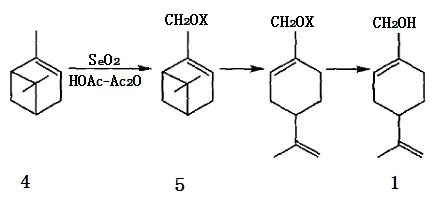
图2 α-蒎烯用SeO2 氧化合成紫苏醇
4、β-蒎烯环氧化物重排法
Bluthe等利用β-蒎烯环氧化物(6)在汞离子存在下与水作用,首先生成二醇,再在稀硫酸催化下脱水后可定量地转化成紫苏醇;这一方法在Sy-narome等的一份专利中也有报导,据称紫苏醇的得率可达98%,但反应中硫酸汞的用量几乎是环氧蒎烷的一倍,实为不足之处。β-蒎烯环氧化物在酯酸钠存在下与羧酸RCOOH(R=H、Me、Et、tPr)反应可转化成醇和相应酯的混合物,经水解可制得紫苏醇。2,10-环氧蒎烷的酸催化异构化是综合利用我国资源丰富的松节油中的β-蒎烯来合成紫苏醇的最有效的途径,由于2,10-环氧蒎烷可以很方便地由β-蒎烯经环氧化反应制备,这也为β-蒎烯资源的综合利用提供了一条新途径(图3)。
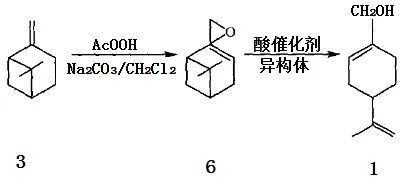
图3 2, 10-环氧蒎烷在酸催化下的异构化反应
5、紫苏醇的生物转化
(1)、含CYP153A6的重组微生物细胞区域选择性羟基化(S)-柠檬烯为(S)-紫苏醇[1]
细胞生理是决定微生物生物催化剂反应效率的关键因素。为探索细胞色素P450单加氧酶CYP153A6重组恶臭假单胞菌细胞将(S)-柠檬烯羟基化转化为(S)-紫苏醇的有效工艺条件,对其生理参数进行了优化。之前报道的putida GPo12合成(S)-紫苏醇的方法是基于复杂而敏感的辛烷摄食策略,表明了细胞生理学的关键作用。与之前的研究结果相比,对不同碳源的筛选表明,甘油和柠檬酸是辛烷的合适替代品,具有较高的柠檬烯羟基化活性。putida KT2440作为替代宿主菌株和柠檬酸盐作为碳源改善了实际处理,并允许比活性增加7.5倍(22.6 U gCDW -1)。在两液相生物转化中,在24小时内生产了4.3 g (S)-紫苏醇Ltot (-1),与以前报道的结果相比,生产率提高了6倍。因此,在活微生物细胞中选择性细胞色素p450烃类氧化功能化过程中,细胞生理与目标生物转化之间的关系至关重要,了解这一关系可以指导生物催化剂和生物过程的设计。
在本研究中,Cornelissen等详细研究了是哪些生理参数限制了含CYP153A6的整个假单胞菌细胞催化(S)-柠檬烯羟基化为(S)-紫苏醇(图4),目的是开发一种高效的生物转化过程。
虽然基于细胞色素细胞的生物氧化具有很高的工业应用潜力,但所取得的生产力往往太低,不具有经济意义。在两液相生物转化中,(S)-柠檬烯转化为(S)-紫苏醇受细胞生理限制,而不受CYP153A6固有特性的限制。谨慎的宿主和碳源选择允许休眠细胞的比活性增加7.5倍。在双液相生物转化中,优化的生理条件和过程控制转化为6倍的生产率比以前报道的结果。确定的进一步限制包括底物可用性和过度氧化。可以预见,类似的参数限制了许多其他基于CYP2的生物转化的反应效率。因此,强烈建议在设计全细胞催化剂时考虑生理效应。
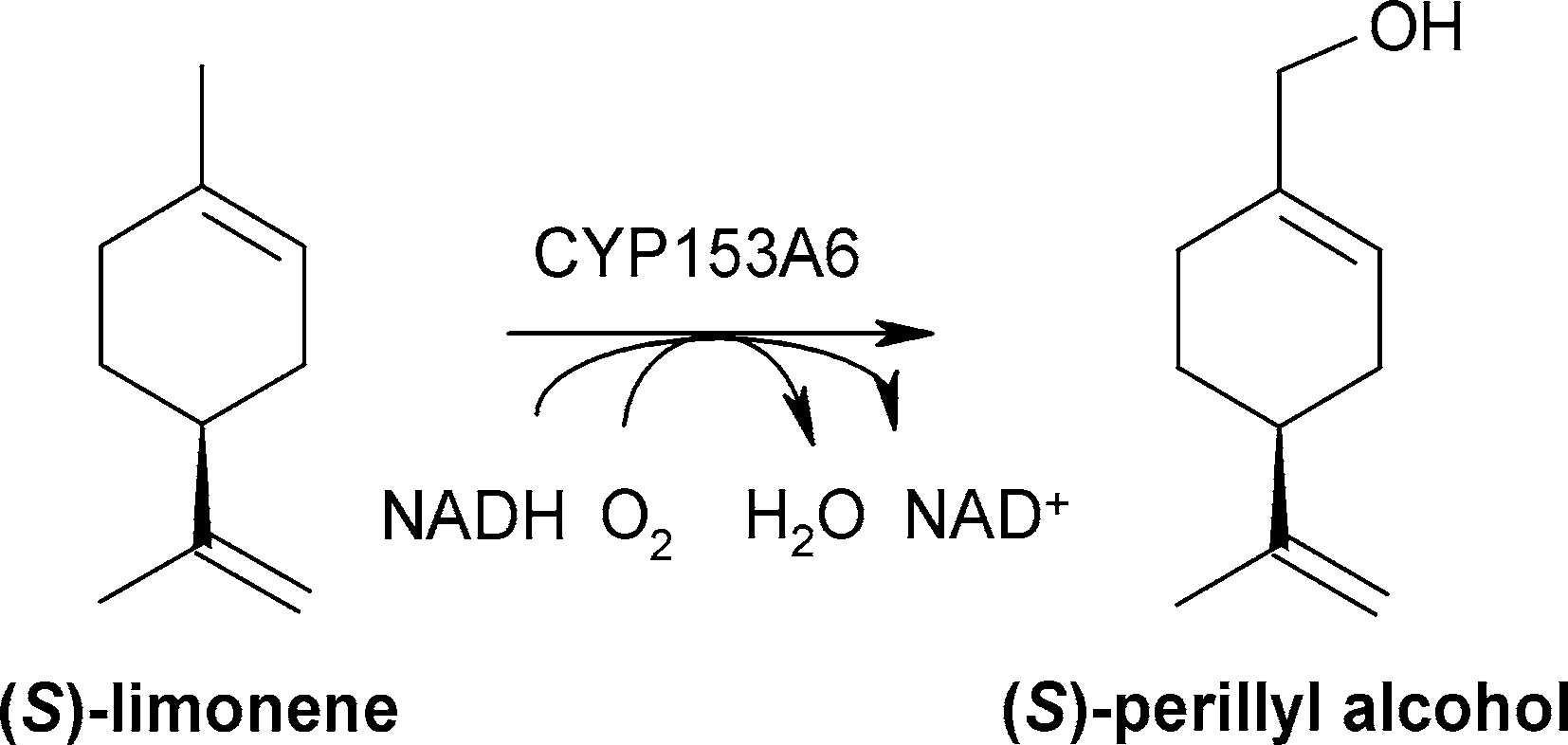
图4 紫苏醇的生物转化 [1]
(2)、重组大肠杆菌对紫苏醇生产的影响[2]
(R)-(+)-紫苏醇是一种天然含氧单萜,广泛用于天然香料添加剂、杀虫剂、喷气燃料和抗癌疗法。它也是容易获得的单萜前体。然而,这种天然产物存在于低浓度的植物来源,这在经济上是不可行的。因此,微生物生产方法正迅速成为一种有吸引力的替代方法,使(R)-(+)-紫苏醇生产更加可持续和环境友好。[2]
Sun等设计了一种外源的甲羟戊酸(MVA)途径,包括柠檬烯合成酶、对伞花烃单加氧酶羟化酶和对伞花烃单加氧酶还原酶,用于生产(R)-(+)-紫苏醇。从葡萄糖中得到(R)-(+)-紫苏醇的单萜前体(R)-(+)-柠檬烯的浓度达到45 mg/L。从而实现了(R)-(+)-紫苏醇的增强型生产。该菌株在5l的间歇式生物反应器中产生(R)-(+)-紫苏醇,滴度为87 mg/L,葡萄糖产率为1.5 mg/g。这些数据强调了通过甲戊酸途径从葡萄糖高效生产(R)-(+)-紫苏醇。该方法为今后生产其他单萜类化合物提供了参考依据。[2]
众所周知,在(S)-(−)-紫苏醇生产过程中,使用大肠杆菌可使滴度提高100 mg/L。许多萜类化合物已经通过代谢工程高效价生产,包括单萜、倍半萜、二萜和四萜。以嗜热硬脂芽孢杆菌(LHBS)的柠檬烯羟化酶为底物(R)-(+)-柠檬烯可产(R)-(+)-紫苏醇0.51 mg/L。将LHBS连接到pET28a(+)中创建pSC00,同时创建pSC01中的cymAa和cymAb。柠檬烯对大多数微生物具有毒性,其浓度可以调节BL21 (DE3)的生长。因此,评价间歇式生产加料中柠檬烯的最佳浓度是很重要的。不同(R)-(+)-柠檬烯浓度评估(0.2 mM至3.0 mM)的生长试验。随着(R)-(+)-柠檬烯浓度的增加,细胞生长受到抑制。在(R)-(+)-柠檬烯浓度为1.0 mM时,SC01的OD600从2.5下降到2.0。当(R)-(+)-柠檬烯用量为2 mM时,SC01的最大产量为86.9 mg/L,紫苏醇的转化率为30%。另一株菌株SC00产生1.5 mg/L的低浓度,细胞生长受到抑制。在后续的研究中,以菌株SC01为研究基础。产物经乙酸乙酯有机萃取后经GC-MS鉴定。对照试验中大肠杆菌提取物缺乏cDNA克隆,不产生(R)-(+)-紫苏醇,而携带恶臭假单胞菌cymAa和cymAb的大肠杆菌产生的(R)-(+)-紫苏醇达到可检测量。实验结果表明以(R)-(+)-柠檬烯为底物成功构建了(R)-(+)-紫苏醇的生物合成途径。
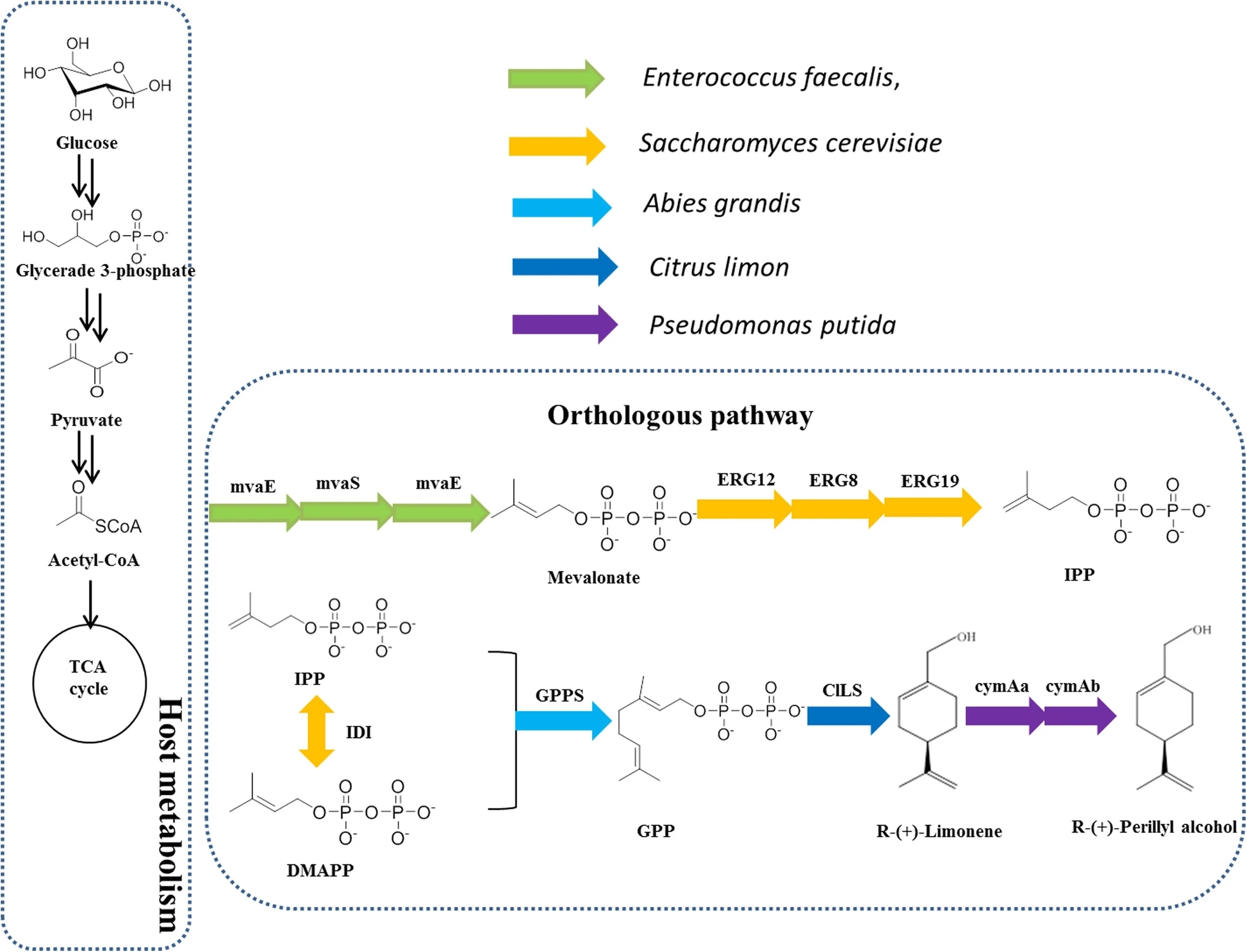
图5 通过MVA途径产生(R)-(+)-紫苏醇
应用领域
1、紫苏醇作为单体香料,是赋予枯茗香气、龙涎香气的化合物,可用于仿制柑橘、香草、水果型的食用香精,食品的赋香剂和酱油的防腐剂。
2、有机合成重要中间体,紫苏醇是合成紫苏醛、紫苏葶等的关键中间体。
3、合成植物生产调节剂、农用杀虫剂和昆虫拒食剂。
4、紫苏醇具有独特的药用效果,用于器官移植,可以降低同种异体移植物的排斥作用。
5、紫苏醇作为一种治疗及预防癌症的单萜类药物,具有广谱、高效、低毒的抗癌作用特点,在肿瘤,如卵巢肿瘤、食道癌、乳腺癌等的治疗方面有独到的治疗效果。
生物活性
Perillyl alcohol 是一种单萜醇,从薰衣草,薄荷,樱桃等植物精油中分离出来。Perillyl alcohol 可在不影响正常细胞的情况下诱导肿瘤细胞凋亡 (apoptosis)。
1、紫苏醇(单萜醇),柠檬烯
天然产物在传统药物中有着悠久的使用历史,在过去的几十年里,它们对不同疾病的作用一直是许多基础和临床研究的焦点。精油是一种含有植物芳香化合物的挥发性液体,被称为中草药中的有效成分。紫苏醇(Perillyl alcohol, POH)通常可从饮食中获得,目前正在探索其抗癌化学预防、肿瘤生长抑制和肿瘤消退的作用。柑桔果皮是果汁制造业的废弃物,多年来一直被视为环境绿色生态政策的关键问题。克服这一问题最著名的方法之一是利用特定的细菌或酵母菌株来转化这些单萜。柠檬烯(1-甲基-4-异丙基-环己烯)是一种单萜,因为其他单萜由两个异戊二烯单元组成,占柑橘精油的90%以上,存在于许多水果和蔬菜中。尽管d -柠檬烯的抗癌活性早在20年前就已被发现,但它最近在转化医学上引起了更多的关注。在本章中,我们将概述POH和d -柠檬烯的抗癌作用。稍后,我们将讨论这些化合物的药代动力学,重点介绍这些蛋白质针对的信号通路,回顾在不同癌症模型中对这些化合物进行的临床试验,最后讨论了该领域未来的研究方向,可能更适用于未来的癌症治疗策略。
虽然目前还不清楚POH是如何激发其抗肿瘤作用的,但已经报道了一些潜在的重要机制。一种可能的机制是在不影响正常细胞的情况下,诱导和增强肿瘤细胞中转化生长因子-β (TGF-β)信号转导途径的表达,进而引发细胞凋亡,诱导细胞停滞。然而,其他可能的机制包括,例如,抑制下游ras信号通路,调节AP-1(激活蛋白-1)的活性,G1早期阻滞,分化,抑制小Rho-GTPase蛋白的异丙烯化,生长因子的诱导,以及调节细胞周期检查点蛋白的活性(图6)。

图6 柠檬烯和紫苏醇(POH)抗肿瘤作用示意图。柠檬烯和POH在参与肿瘤进展和消退的一些关键途径中具有多种抑制和刺激作用。这两种天然产物都在细胞死亡的调控中发挥重要作用。柠檬烯通过上调BAX、释放细胞色素c、caspase-3、-9、TGF-β和下调抗凋亡Bcl-2发挥作用。POH还上调Bak、caspase-3、FasL、TGF-β、c-fos和c-Jun,并阻断ERK1/2磷酸化和Mek-Erk通路。柠檬烯和POH都可以通过下调癌细胞中VEGF的基础生成来抑制肿瘤进展。它们还能抑制甲戊酸途径以及小G蛋白的异戊烯化,导致肿瘤消退。
POH可通过抑制甲戊酸途径发挥胆固醇生物合成的调节作用。根据对胆固醇生物合成的影响,有报道称,在一项研究中观察到,服用POH的老鼠体重下降了近10%,这是由于体脂减少。先前的研究也表明,POH能够通过阻断3-羟基-3-甲基戊二酰辅酶A向甲戊酸的转化,进而抑制小Rho-GTPase蛋白和3-羟基-3-甲基戊二酰辅酶A还原酶的合成来影响甲戊酸途径,导致异戊烯化Ras和Ras相关蛋白的活性降低。因此,它被认为是一种戊烯基转移酶抑制剂。法尼酰基化是Ras基因突变体活性所必需的,而法尼酰基转移酶(FTase)抑制剂可阻断Ras基因的致癌活性。然而,一个有趣的说法是,这种单萜可以以一种不依赖Ras的方式对白血病细胞产生抗癌作用。这一发现支持了一种观点,即在Ras依赖和Ras独立途径中,存在其他可能的机制导致其对不同类型的恶性细胞的癌症化学预防作用。在不影响正常对照的情况下,Bcl-2同源拮抗剂/杀手(BAK)在肿瘤中诱导凋亡(一种促凋亡蛋白),证实POH对胰腺癌的增殖抑制作用。POH作用于肝脏肿瘤的机制是通过刺激TGF-β和M6P/IGF II(甘露糖-6-磷酸/胰岛素样生长因子-II)受体,增加肿瘤细胞的损失率。抑制丝裂原/细胞外信号调节激酶(Mek) -细胞外信号调节激酶(Erk)通路被认为是POH的另一作用机制。与这一观点一致的是,另一项研究报道POH通过阻断K562细胞中的ERK1/2磷酸化和小GTPase信号通路,在诱导细胞凋亡中发挥关键作用。这些结果表明,POH可能有几个靶点,当被该途径激活时,可能是关键的癌症治疗。POH还可以下调癌细胞中血管内皮生长因子(VEGF)的基础生成,上调内皮细胞中血管生成素-2的释放,导致肿瘤消退。POH的靶向途径见图6。
一项研究表明,在胶质瘤细胞中,POH通过增加Fas配体的表达来发挥其作用,从而增强化疗的传递和疗效。POH的化学预防作用通过抑制UVB诱导的AP-1活化在体内外皮肤肿瘤的促进作用得到证实。这一发现与在人乳腺肿瘤细胞株T47D-C4-2W中的研究结果不一致,该研究表明poh通过c-Jun n端激酶/应力激活蛋白激酶途径诱导c-fos和c-Jun(两个相互结合形成AP-1的癌蛋白)的转录活性,并随后激活AP-1。另一项临床前研究证实POH在乳腺癌中通过改变c-Jun和c-fos的功能,并诱导BAX和bad等促凋亡基因表达,参与TGF-β下游基因表达的激活和AP-1的诱导。c-Jun和c-fos在细胞凋亡前和凋亡过程中均被激活,POH的刺激可能是导致细胞死亡的信号级联的早期关键事件。POH对雄激素受体(AR)基因表达的抑制和对c-Jun表达的刺激可减弱AR介导的雄激素反应性前列腺细胞的作用。POH也被证明参与抑制人类乳腺癌细胞株的细胞生长、细胞周期进展和cyclin D1基因表达。其他体外研究报道了POH对胰腺癌和肺癌细胞[52]生长的抑制作用。研究证实,细胞周期蛋白D1和E的降低、p21 (Cip1/Waf1)的增强和PCNA表达的降低有助于在培养的人乳腺癌细胞中实现细胞周期阻滞。这是POH在裸鼠系统中抗人乳腺癌细胞增殖和转移的作用机制。Balassiano等研究了POH对胶质细胞C6细胞系和鸡胚绒毛膜模型的影响,发现POH在体外和体内均发挥了抗转移分子的作用。体外实验表明,POH通过破坏细胞骨架机制来抑制乳腺细胞的迁移,而不影响细胞黏附。体外研究表明,POH在神经母细胞瘤衍生的神经- 2a细胞中起诱导分化作用。将这些细胞与POH孵育后,发现它抑制了DNA合成。对POH诱导肿瘤生长衰退部位的组织学观察表明,POH与肿瘤细胞的再分化有关。最近,人们提出了另一种POH抑制前列腺癌进展的机制,该机制可以通过独特的协同降低hTERT(人端粒酶逆转录酶)蛋白翻译和破坏hTERT - mtor(雷帕霉素的机制靶点)-RAPTOR蛋白复合物来调节端粒酶活性。结果证实了致瘤性休克的假说。他们发现POH对端粒酶和TERT蛋白的调节与eIF4E(真核翻译起始因子4E)水平高相关,而对eIF4E水平低的正常pMV7细胞则无影响。POH的作用机理概述如图6所示。
2、单萜紫苏醇:抗癌剂和克服生物屏障的介质
紫苏醇(POH)是一种与柠檬烯有关的天然单萜,存在于各种植物的精油中。它有多种用途,可以在家庭用品中找到,包括食品、化妆品和清洁用品。在过去的三十年里,人们也对其潜在的抗癌活性进行了研究。尽管鼻腔内POH制剂在恶性胶质瘤患者中产生了令人鼓舞的结果,但在癌症患者中使用口服POH制剂的临床试验未能实现预期的治疗效果。基于它的两性特性,POH显示了克服生物屏障的能力,主要是血脑屏障(BBB),但也有细胞质膜和皮肤,这似乎是POH在药物开发和传递方面的重要贡献。在这篇综述中,我们介绍了POH的物理化学性质,这是它能够克服不同类型生物屏障所带来的障碍的基础,从而塑造了它在癌症治疗和药物开发中的多方面前景。我们总结和评价了大量的临床前和临床研究,这些研究探讨了POH在鼻内给药和鼻到脑的药物运输、其动脉内给药用于血脑屏障打开以及其在杂化分子中的渗透增强功能,POH与其他治疗药物结合或偶联,产生具有新的作用机制和应用的新的化学实体。[4]
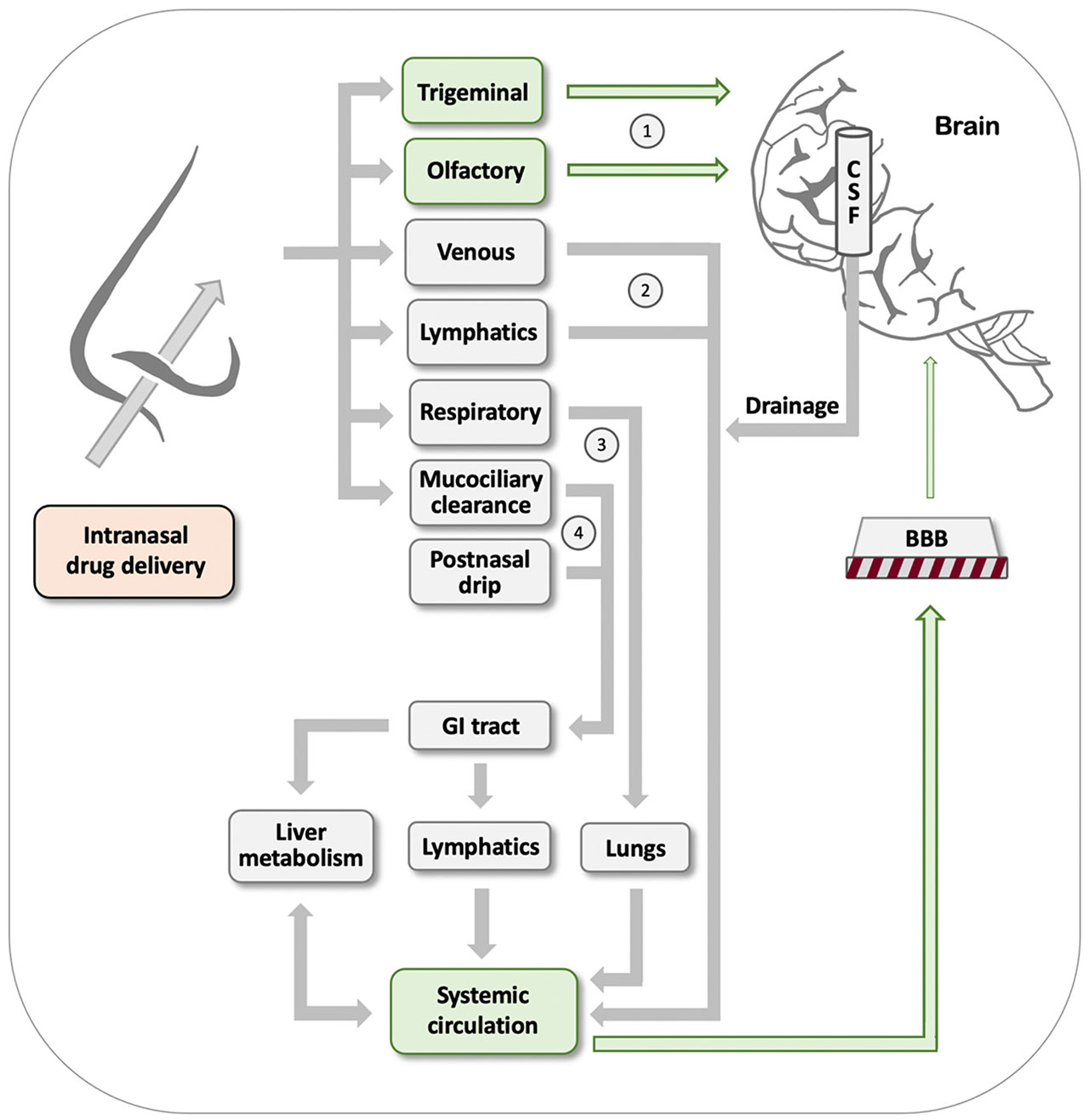
图7 可用于鼻内给药的途径。经鼻给药后,药物可能通过几种截然不同的途径到达大脑:通过三叉神经和嗅觉神经(标记为1)直接从鼻子到大脑的运输,或通过标记为2-4的机制首次进入血液的间接运输。然而,在后一种途径中,药物会遇到血脑屏障,这阻止了绝大多数药物制剂有效地进入大脑。详情请参阅文本。[4]
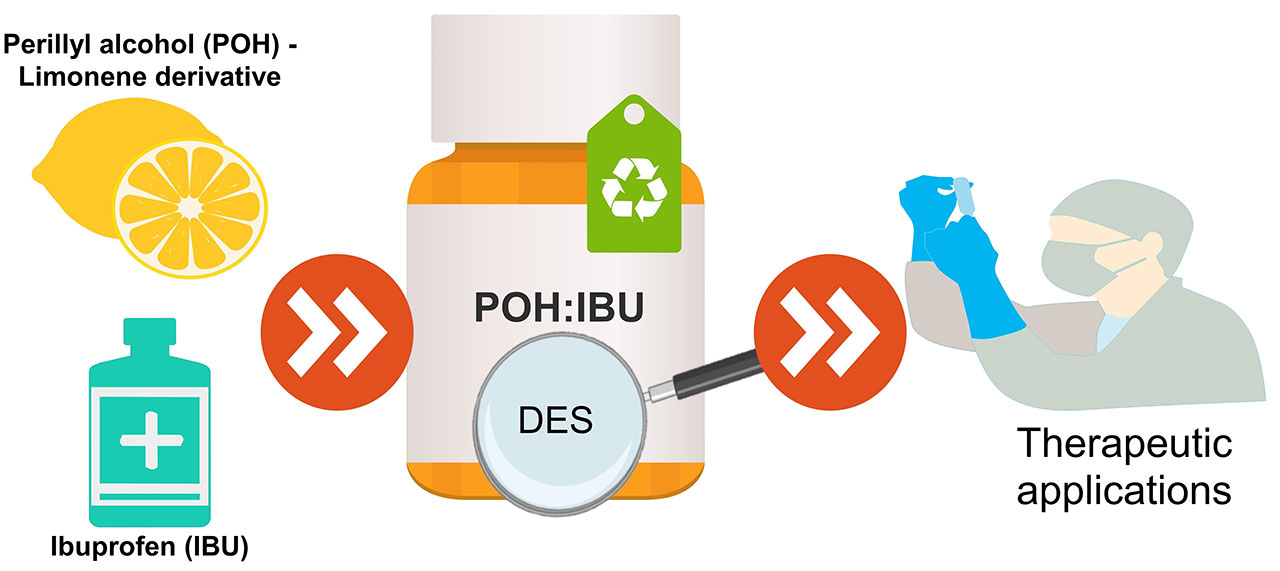
3、紫苏醇和布洛芬基底物的优化设计
治疗性深共晶体系(THEDES)由于能够提高活性药物成分(APIs)的生物利用度,在制药领域得到了广泛的应用。然而,它们的生物学性能还没有被仔细研究过。以紫苏醇(POH)和布洛芬(IBU)为原料,采用不同的摩尔比制备了二乙基醚。我们的综合策略包括表征它们的热和结构行为,以确定成功形成深共晶体系的摩尔比。制备的不同体系的体外溶解度表明,与其他报道的例子不同,萜烯的存在并不影响抗炎剂在生理模拟介质中的溶解度。该系统的生物性能是研究他们的抗菌活性对广泛的微生物菌群。除铜绿假单胞菌外,THEDES对所有供试菌株均有抗菌活性。验证了POH和IBU作为共晶体系的结合具有协同效应。此外,在体外细胞模型中,也评估了这些共晶系统对结直肠癌(CRC)的细胞毒性。结果表明,细胞活力以剂量依赖性的方式变化,有选择性的THEDES作用于CRC细胞。随着可调节的生物活性在一个比例依赖的方式,THEDES增强了抗菌和抗癌的特性,代表了一个可能的替代传统疗法。因此,本研究为基于POH和IBU的THEDES作为新型活性药物系统的强大候选药物的应用提供了可预见的方向。[5]
4、不同载体中紫苏醇的释放
背景:皮肤癌是人类最常见的恶性肿瘤,在过去的几十年里,皮肤癌的病例数量急剧增加。因此,开展新的和更安全的抗癌天然药物(如紫苏醇)和现代药物传递系统(如纳米制剂)的研究,以提高其生物利用度是非常重要的。
目的:研究不同剂型紫苏醇的体外缓释作用,并比较其缓释效果。利用选定的数学模型确定了释放动力学。
方法:采用水凝胶、O/W纳米乳液、O/W大乳液和纳米脂质载体作为紫苏醇的载体。使用Spectra/Por标准再生纤维素膜,在温度T=32℃下进行活性成分的释放研究。用高效液相色谱法分析了受体溶液中活性药物的浓度。利用选定的数学模型确定了释放动力学。
结果:紫苏醇的释放量分别为水凝胶(35.72±0.21%)、NLC(35.54±1.48%)和纳米乳(34.87±4.49%)。在水凝胶和大乳状液中,其释放遵循fick扩散规律,而在纳米制剂中则表现出一种反常的机制。然而,获得的纳米制剂以及常规水凝胶可被认为是紫苏醇局部给药的潜在载体。[6]
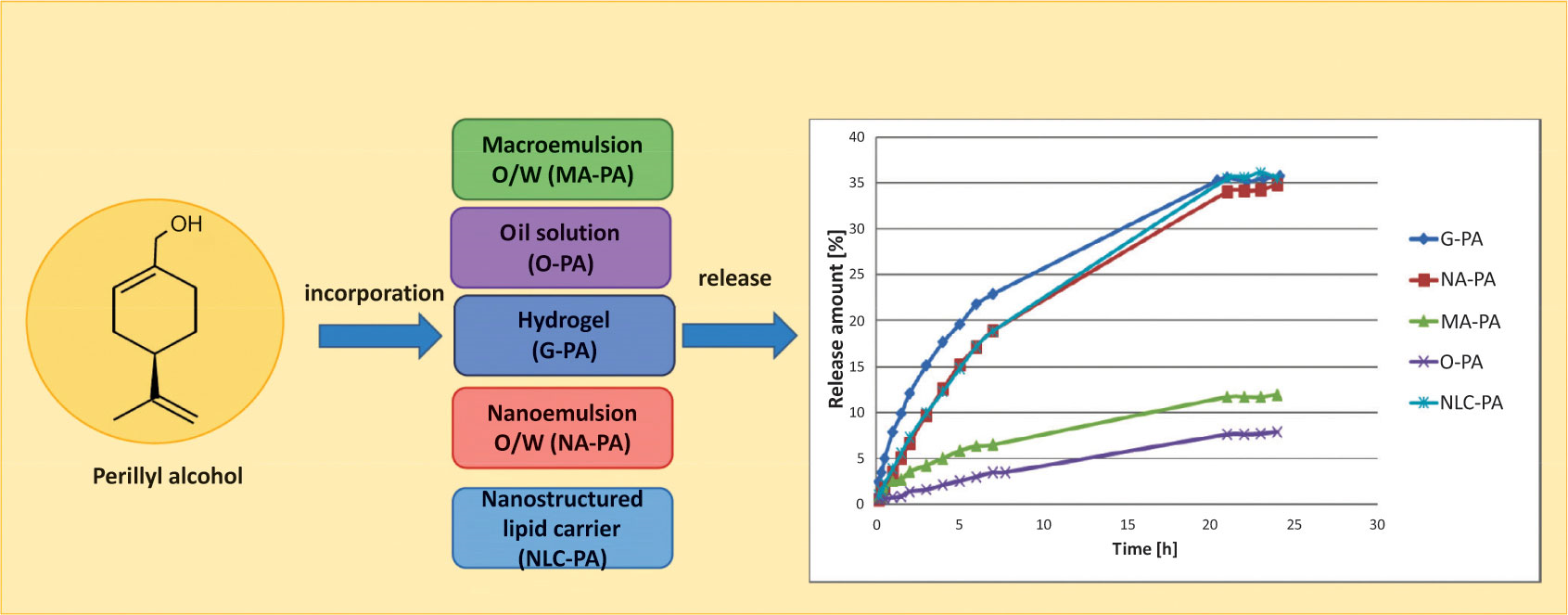
图8 不同载体中紫苏醇的释放动力学曲线[6]
参考文献
[1] Cornelissen, Sjef & Liu, Shanshan & Deshmukh, Amit & Schmid, Andreas & Bühler, Bruno. (2011). Cell physiology rather than enzyme kinetics can determine the efficiency of cytochrome P450-catalyzed C-H-oxyfunctionalization. Journal of industrial microbiology & biotechnology. 38. 1359-70. 10.1007/s10295-010-0919-y.
[2] Sun, C., Dong, X., Zhang, R. et al. Effectiveness of recombinant Escherichia coli on the production of (R)-(+)-perillyl alcohol. BMC Biotechnol 21, 3 (2021). https://doi.org/10.1186/s12896-020-00662-7
[3] Shojaei, Shahla & Kiumarsi, Amir & Rezaei Moghadam, Adel & Alizadeh, Javad & Marzban, Hassan & Ghavami, Saeid. (2014). Perillyl Alcohol (Monoterpene Alcohol), Limonene. 10.1016/B978-0-12-802215-3.00002-1.
[4] Chen TC, da Fonseca CO, Levin D, Schönthal AH. The Monoterpenoid Perillyl Alcohol: Anticancer Agent and Medium to Overcome Biological Barriers. Pharmaceutics. 2021; 13(12):2167. https://doi.org/10.3390/pharmaceutics13122167
[5] Silva E, Oliveira F, Silva JM, Matias A, Reis RL, Duarte ARC. Optimal Design of THEDES Based on Perillyl Alcohol and Ibuprofen. Pharmaceutics. 2020; 12(11):1121. doi. 10.3390 / pharmaceutics 12111121
[6]Miastkowska Malgorzata *, Konieczna Monika , Lason Elwira , Tabaszewska Malgorzata , Sikora Elzbieta and Ogonowski Jan, The Release of Perillyl Alcohol from the Different Kind of Vehicles, Current Pharmaceutical Biotechnology 2018; 19(7) .doi.org/10.2174/1389201019666180730165330