服务热线
177-5061-9273

| 中文名 | 桉树醇 |
| 英文名 | Cineole |
| 别名 | 桉树脑 桉叶油醇 1,8-环氧对孟烷 欧卡那卜托 1,3,3-三甲基-2-氧杂双环[2.2.2]辛烷 |
| 英文别名 | eucalyptol(e) 1,3,3-Trimethyl-2-oxabicyclo[2.2.2]octane 1,8-Cineole 1,8-Epoxy-p-menthane 1,8-Oxido-p-menthane Eucalyptol 1,8,8-trimethyl-7-oxabicyclo[2.2.2]octane |
| CAS | 470-82-6 |
| EINECS | 207-431-5 |
| 化学式 | C10H18O |
| 分子量 | 154.249 |
| inchi | InChI=1/C10H18O/c1-9(2)8-4-6-10(3,11-9)7-5-8/h8H,4-7H2,1-3H3/t8-,10+ |
| 密度 | 0.922g/cm3 |
| 熔点 | 1.5℃ |
| 沸点 | 174°C at 760 mmHg |
| 闪点 | 50.9°C |
| 蒸汽压 | 1.65mmHg at 25°C |
| 折射率 | 1.461 |
| 物化性质 | 无色油状液体。有像樟脑的气味。相对密度0.921-0.923(25/25℃),熔点1-1.5℃,沸点174-177℃,折射率1.4550-1.4600(20℃)。微溶于水,溶于乙醇、乙醚、氯仿、冰醋酸、动植物油。化学性质稳定。 |
| 产品用途 | 广泛用于医药,也用于配制牙膏香精等。 |
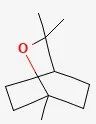
桉叶醇的分子结构式
桉叶油醇(1, 8-Cineole; Cajeputol; Eucalyptol)又名桉叶醇、桉树脑、桉叶油醇等,是无色油状透明液体,广泛存在于天然芳香油中,为桉叶油的主要成分。桉叶油醇有樟脑气息和清凉的草药味道,具有杀菌和杀虫作用,多用于医药和食品香料,还常用作防腐剂。无色至淡黄色油状透明液体。沸点176℃,熔点1~1.5℃,凝固点1℃,闪点47~48℃。溶于乙醇、乙醚、氯仿、冰醋酸、丙二醇、甘油和大多数非挥发性油,微溶于水。天然品存在于桉叶油等200余种天然精油中。

生产方法
桉树脑广泛存在于天然芳香油中,为桉叶油的主要成分。桉树脑可以芳香油中单离制得。例如将桉叶油分馏,收集175-180℃馏分,稍加精制即可。如需制造纯度较高的产品,可将芳香油中分馏得到的桉树脑加以冷却,通入HCI干燥。分离出盐酸及桉树脑结晶,用热水分解结晶,再经精馏即得纯粹的桉树脑。
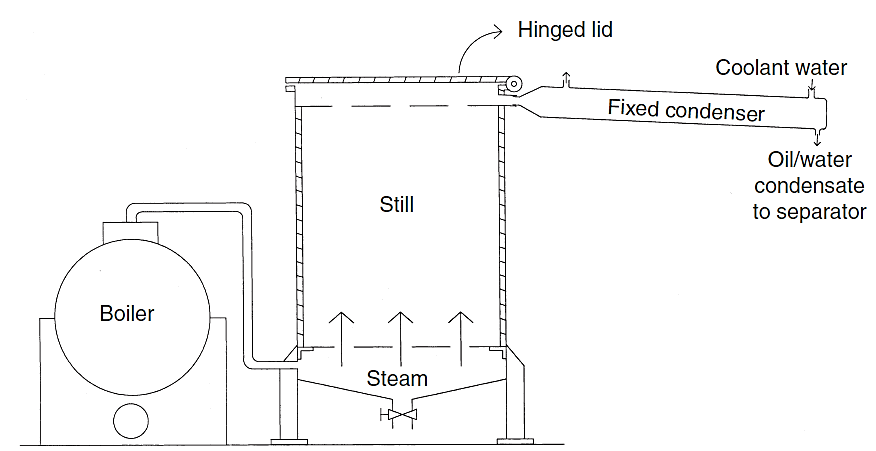
图1 蒸汽蒸馏法用单独的锅炉提取蓝桉精油 [1]
合成法是将萜品转化成酸,再脱水而得。生产方法由桉叶油、蓝桉油等含桉叶醇较多的精油,取170~180℃精馏分,经冷冻或在冷冻下分馏单离而得。具体步骤如下:
松油醇合成桉叶油醇的方法,包括如下步骤:1) 将松油醇与二氯甲烷质量比为1:13,松油醇与固体催化剂三氟甲磺酸锌质量比为1:10.4加入到反应瓶中;常温常压下,在氮气保护下用搅拌器搅拌4h,转速为80转/min,至反应结束后静置25min,得到反应溶液Ⅰ;2) 在反应溶液Ⅰ中加入二氯甲烷,松油醇与二氯甲烷质量比为1:6,用搅拌器搅拌1h,转速为40转/min,得到反应溶液Ⅱ;3) 在反应溶液Ⅱ加入饱和碳酸氢钠溶液进行萃取,松油醇与饱和碳酸氢钠溶液质量比为1:19,静置分层10min,取下层溶液,得到反应溶液Ⅲ;4) 用饱和食盐水洗涤反应溶液Ⅲ,松油醇与饱和食盐水质量比为1:14.4,洗涤分3次进行;加入无水硫酸钠干燥,松油醇与无水硫酸钠质量比为1:9.6;使用旋转蒸发仪旋干得到淡黄色透明液体,即桉叶油醇溶液。经GC检测,计算得桉叶油醇转化率为65.5%。
桉叶醇的生物合成
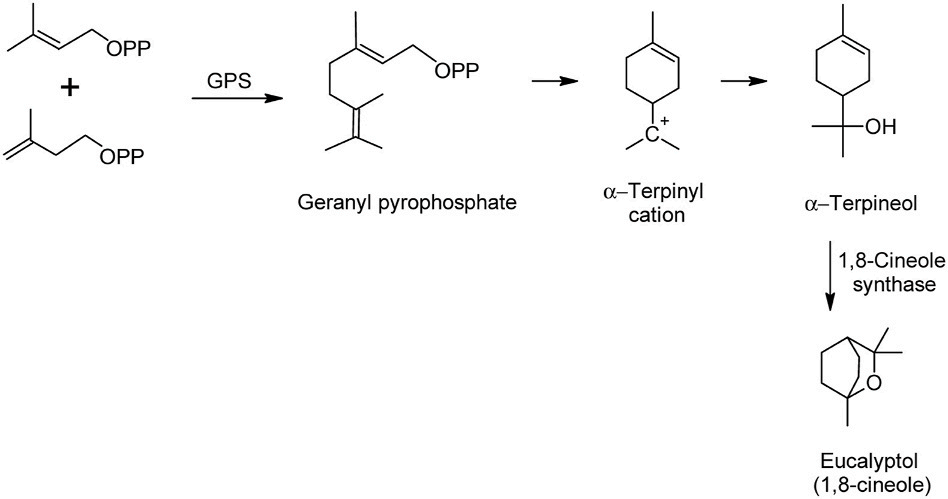
图2 桉叶醇的生物合成路线 [2]
桉树醇和其他萜类化合物是通过异戊二烯生物合成途径在这些植物中产生的。该途径首先由异戊烯基二磷酸(IPP)和二甲基烯丙基二磷酸(DMAPP)通过香叶酰二磷酸合酶(GPS)缩合得到香叶酰焦磷酸。在桉树醇的生物合成过程中,香叶酰焦磷酸经过焦磷酸的消除和环化形成α-松油基阳离子(图2)。α-松油基阳离子反应生成α-松油醇。α-松油醇转化为桉油醇的反应由1,8-桉油醇合成酶催化。[2]
毒性GRAS(FEMA): LD502480mg/kg(大鼠,经口)。
使用限量FEMA(mg/kg):软饮料0.13;冷饮0.50;糖果15;焙烤食品0.50~4.0;胶姆糖190。适度为限(FDA§172.515,2000)。
用途1
GB2760一96规定为允许使用的食品用香料。主要用于止咳糖、人造薄荷等中。
用途2
是薰衣草油和穗薰衣草油的固有成分之一,是配制这类精油必用的香料。适量用于药草型如薰衣草、新刈草和香薇型香精中,有增加新鲜感的效果。用于药皂、喷雾剂或化妆品香精和其他卫生用品,如牙膏等,有杀菌作用。工业制品中可用作不良气息的掩盖剂。也用于食用香精。
用途3
用于口腔剂香精的调配和医药产品的制造,作为食品添加剂,日本《食品添加物公定书》规定桉树脑纯度85%以上,不得用于加香以外的目的。用途广泛用于医药,也用于配制牙膏香精等。
桉叶醇的药理活性
1、青蒿精油和桉树醇通过非毒性代谢途径激活Nrf2-Keap1,促进APAP清除,从而预防对乙酰氨基酚诱导的肝损伤
长期以来,在东亚,青蒿一直被用于传统医学,并作为不同功能的食物来源。蒿属植物(Artemisia vulgaris L., AV)是蒿属植物的一种。采用亚临界丁烷萃取法从AV中提取精油。采用电子鼻顶空固相微萃取-气相色谱法(HS-SPME-GC-MS)检测EO含量。为探讨桉树醇和桉树油对小鼠肝损伤的保护作用。单独使用对乙酰氨基酚(APAP)可导致严重的肝损伤,其特点是血清AST和ALT水平显著升高,ROS和肝脏丙二醛(MDA)水平显著升高,肝脏超氧化物歧化酶(SOD)和过氧化氢酶(CAT)耗损。EOs显著减轻apap诱导的肝脏损伤。进一步研究证实桉树醇是Keap1的抑制剂,桉树醇与Keap1的亲和力KD为1.42 × 10e−5,增加了Nrf2从细胞质向线粒体的转运。激活的Nrf2增加尿苷二磷酸葡萄糖醛基转移酶(UGTs)和磺基转移酶(sulfotransferases)的mRNA表达,抑制CYP2E1的活性。因此,激活的Nrf2抑制毒性中间物的形成,促进APAP肝非毒性,使APAP代谢成APAP-gluc和APAP- sulc。总的来说,桉树醇可以促进APAP的无毒代谢,从而保护肝脏免受APAP诱导的损伤,这表明桉树醇或EOs可能是一种天然的肝保护剂。[3]
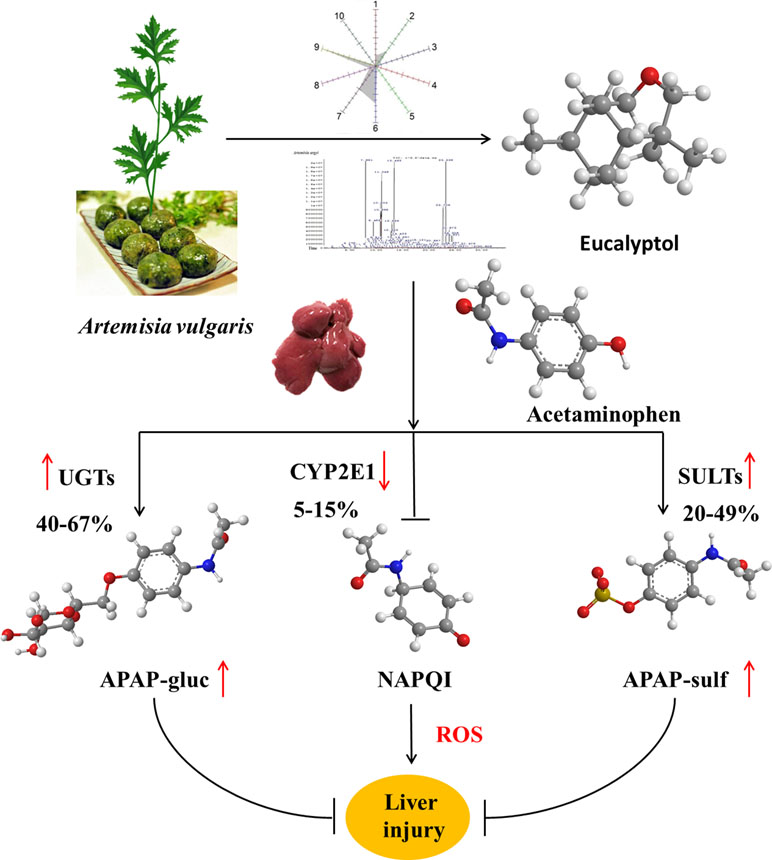
图3 青蒿油及桉油醇抗肝损伤的机理 [3]
与苦艾属(A. absinthium)、尼罗河蒿属(A. nilagirica)和荒漠蒿属(A. deserti)相比,AV是一种著名的蒿属植物。AV-EOs富含桉叶醇和顺式-β-松油醇,具有抗炎和抗氧化作用,可对抗多种疾病,包括呼吸系统疾病、胰腺炎、结肠损伤和非酒精性脂肪性肝炎。在我们的研究中,AV-EOs和桉树醇显著减轻了APAP过量(300 mg/kg),并诱导了血清转氨酶和肝脏组织病理学损伤的增加(图3),表明AV-EOs具有预防APAP引起的肝毒性的能力。[3]
许多关于青蒿的研究并未在食物/水消耗量、体重、死亡率、血液学、血清生化、器官重量和组织病理学方面造成任何显著的不良影响;高剂量(752 mg/kg)使用青蒿可能会因诱变和肝毒性而对健康造成危害,这表明不建议将青蒿提取物高剂量应用于严重疾病的治疗。青蒿可能有神经毒性;由于侧柏酮(thujone)的主要活性,它能以剂量依赖的方式抑制γ -氨基丁酸A (GABAA)受体引起的兴奋和惊厥。在我们的研究中,AV-EOs不含侧柏酮,而青蒿挥发油的剂量低于毒性剂量。实验结果表明,普通青蒿挥发油(5%,100 ml/kg)对小鼠肝脏无明显的损伤作用。APAP组肝脏指数显著高于对照组,而APAP-EO (AV)、EO与对照组肝脏指数无显著差异。与EO治疗后的EOs化合物及肝功能指标比较,我们推测低剂量的AV是安全的。[3]
APAP在肝脏中具有无毒和有毒的代谢途径。在无毒途径中,在UGT和SULT家族的参与下,APAP被葡萄糖醛酸化和硫酸酸化为APAP-gluc和APAP- sulc,并排泄到血液和胆汁中。本研究中,桉树醇处理后,UGT1A1、UGT1A6、UGT1A9、SULT1A1和SULT2A1水平显著升高,表明桉树醇通过无毒途径促进APAP代谢。Nrf2基因,在TGAG/CNNNGC (N代表任何碱基)的共识下,是诱导UGT和SULT家族表达增加所必需的。桉树醇显著提高了Nrf2 mRNA的表达。桉树醇可以直接与Keap1结合在Arg-415位点,即Nrf2-Keap1结合位点。桉树醇对Keap1蛋白有较强的亲和力。激活的Nrf2从细胞质转移到细胞核。Nrf2 mRNA的表达也增加,导致EO处理下核/胞质相对表达增加。此外,Nrf2是一种调节内源性抗氧化酶的转录因子。EOs刺激Nrf2激活。被激活的Nrf2与抗氧化反应元件结合,进一步激活编码抗氧化和解毒功能的基因转录,包括血红素加氧酶-1 (HO-1)、NAD(P)H:醌氧化还原酶-1 (NQO-1)和谷胱甘肽合成酶[谷氨酸-半胱氨酸连接酶催化亚基(GCLC)] 。我们的研究结果表明,EOs增加了Nrf2从细胞质向细胞核的转移,从而导致抗氧化酶(HO-1、SOD和CAT)和II期代谢酶(UGT和SULT)。[3]
APAP的第二代谢途径为毒性反应。过量的APAP通过CYP2E1转移到NAPQI ,经过化学和酶结合到GSH。毒性途径可导致脂质过氧化;抗氧化酶活性降低,活性氧水平升高。在这里,APAP使MDA和ROS水平升高,SOD和CAT活性降低,提示APAP诱导的肝功能障碍是由氧化应激引起的。APAP显著提高CYP2E1的表达,桉树醇显著降低CYP2E1的表达。CYP2E1缺陷小鼠对肝损伤诱导的APAP具有抗性,而人CYP2E1转基因小鼠对APAP转化为NAPQI具有敏感性。结果表明,桉树醇可以抑制CYP2E1的表达,减轻肝损伤。途径分析研究还报道了以下活性化合物:2-丁酮、3-甲基-、1-辛烯、苯甲醛、苯酚、4-甲基-、辛醛、1-壬烯和己醛。这些化合物分别是醛酮还原酶家族1成员C1、醇脱氢酶1B、细胞色素P450 2A6和细胞色素P450 1A2等有效靶标,它们通过细胞色素P450途径和药物代谢-细胞色素P450途径参与外源性代谢,并与CYP2E1的表达有关。[3]
综上所述,AV-EOs可以通过两条途径预防APAP诱导的肝损伤,一是下调CYP2E1的表达,使APAP血浆浓度降低而转化为NAPQI;二是上调解毒途径的表达。上调途径包括与Keap1抑制结合,刺激Nrf2从细胞质转位到线粒体,激活Nrf2,从而增加抗氧化酶(SOD、GSH、CAT、GPx)和II期酶(SULTs、UGTs)的活性(图4)。从而降低APAP血浆浓度,促进APAP无害代谢。[3]
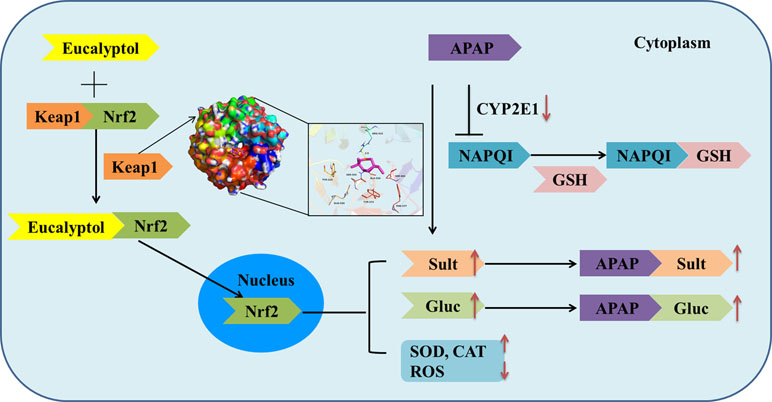
图4 桉树醇保护APAP肝损伤的机制 [3]
2、桉树醇减轻炎症和疼痛反应的小鼠模型的痛风性关节炎
痛风性关节炎是由尿酸单钠(MSU)晶体在关节及关节周围组织的积累引起的,可引起严重疼痛,影响患者的生活质量。桉树醇(1,8-桉树醇)是桉叶精油的主要成分,已知具有抗炎和镇痛作用。本研究旨在探讨桉树醇对痛风性关节炎的治疗作用及其机制。通过在踝关节内注射MSU建立小鼠痛风性关节炎模型。检测踝关节水肿、机械异常痛、中性粒细胞浸润、氧化应激、NLRP3炎症小体、TRPV1表达。桉树醇剂量依赖性地减轻msu引起的机械疼痛和踝关节水肿,其效果与吲哚美辛相似。桉树醇可减少踝关节组织炎症细胞的浸润。桉树醇抑制MSU诱导的踝关节组织NLRP3炎症小体激活和促炎细胞因子的产生。桉树醇可降低MSU诱导的RAW264.7细胞和踝关节组织的氧化应激,提高抗氧化酶活性,降低ROS水平。桉树醇抑制msu诱导踝关节组织和支配踝关节的背根神经节神经元中TRPV1表达上调。通过给小鼠注射抗氧化剂,模拟桉树醇对踝关节水肿、机械痛、NLRP3炎症小体、IL-1β和TRPV1表达的体内作用。桉树醇可减轻MSU引起的疼痛和炎症,其机制可能与抗氧化作用有关。桉树醇和其他抗氧化剂可能是治疗痛风性关节炎的有前途的选择。
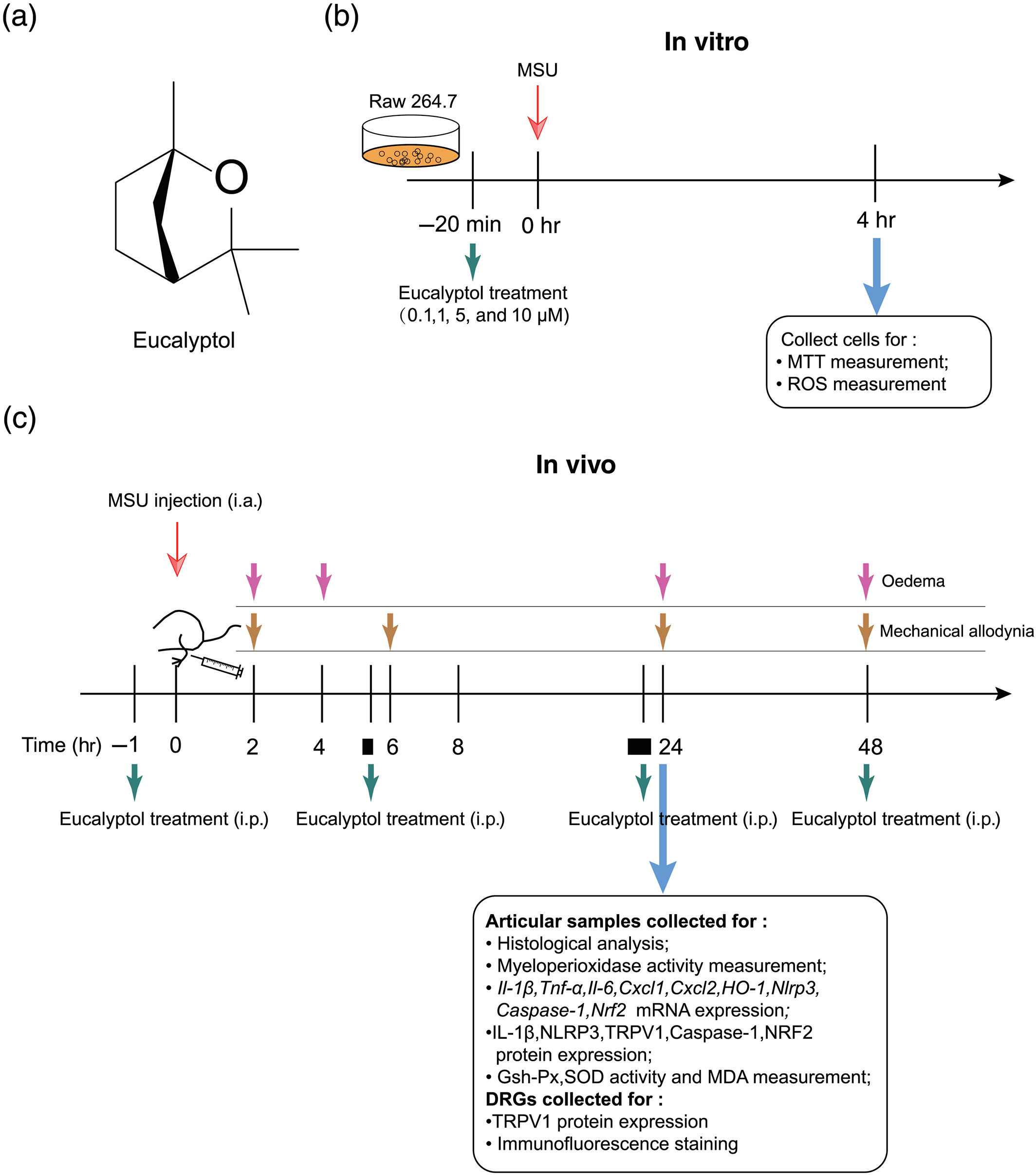
图5 桉树精油的结构和实验规程。(a)桉树醇的分子结构。(b)体外实验方案:RAW264.7细胞接种于六孔板。MSU刺激前20 min (0.5 mg·ml−1)使用0.1 ~ 10 μM的桉树醇。细胞孵育4小时后,进行MTT或ROS检测。(c)体内实验方案:踝关节注射MSU (0.5 mg/20 μl)或PBS (20 μl)建立痛风性关节炎模型或对照组。分别于造模后0、2、4、6、8、24、48 h测量机械过敏和踝关节水肿。分别于MSU注射前1小时和造模后5、23、47小时静脉注射桉树醇(30、100、300、600 mg·kg−1)、吲哚美辛(10 mg·kg−1)和对照品(玉米油),共4次。建立模型24小时后处死小鼠,进行踝关节病理分析、MPO测定、qPCR、western blot和抗氧化活性测定
在本研究中,我们观察了桉树醇在MSU诱导的痛风性关节炎小鼠模型中的抗炎镇痛作用,并将其与常用的治疗痛风的非甾体抗炎药吲哚美辛(indomethacin)进行了比较。我们发现桉树醇能有效减轻MSU引起的机械疼痛、踝关节水肿和踝关节组织中性粒细胞浸润,其效果与吲哚美辛相似。体内研究表明,桉树醇抑制MSU诱导的踝关节组织NLRP3炎症小体的激活和促炎细胞因子的产生。此外,桉树醇还能降低MSU诱导的RAW264.7细胞和踝关节组织的氧化应激。MSU可上调局部踝关节组织和DRG神经元中TRPV1的表达,桉树精可显著降低TRPV1的表达。我们进一步发现,桉树醇对踝关节水肿、机械痛、NLRP3炎症小体、IL-1β和TRPV1表达的体内影响是通过给MSU注射抗氧化剂来模拟的。
桉树醇已被证明在几种炎症条件下具有明显的抗炎作用,包括哮喘、结肠炎、吸烟引起的急性肺部炎症和流感病毒诱导的感染。桉树醇还具有多种疼痛条件下的镇痛作用,包括神经性口面部疼痛和TRPA1通道IL-6应用引起的疼痛,对人类皮肤的激动剂。通过与TRPM8通道的相互作用,我们发现桉树醇对lps诱导的肺部炎症具有抗炎作用,对CFA诱导的炎症性疼痛小鼠模型以及乙酸诱导的内脏疼痛有镇痛作用。本研究发现桉树醇能有效缓解MSU诱导的痛风性关节炎小鼠模型的炎症和疼痛。目前还没有关于桉树醇治疗痛风性关节炎的报道。因此,我们的工作提供了第一个证据表明桉树醇治疗痛风性关节炎。
MSU晶体触发NLRP3炎症小体的激活。NLRP3炎症小体由一系列蛋白质组成,包括NLRP3/ASC/caspase-1,它们负责前IL-1β分裂成活性IL-1β。一方面,IL-1β促进炎症部位中性粒细胞的招募,诱导痛风性炎症。另一方面,IL-1β使外周感觉神经系统的痛觉感受器敏感或直接激活,引起强烈的疼痛。使用中和抗体阻断IL-1β可显著缓解痛风。因此,NLRP3炎症小体的激活在msu诱导的痛风疼痛和炎症的发病机制中起着关键作用。我们的数据表明,桉树醇显著降低了msu诱导的痛风性关节炎小鼠踝关节组织NLRP3、caspase-1和IL-1β的表达。这些结果表明桉树醇可能通过抑制NLRP3炎症小体的激活来缓解msu诱导的痛风性关节炎。
我们进一步研究了桉树醇抑制NLRP3炎症小体的机制。有证据表明,ROS的产生激活了NLRP3炎症小体,而ROS清除物阻断了NLRP3炎症小体的激活。MSU通过ros依赖的方式诱导NLRP3的激活。在本研究中,我们发现MSU在体外和体内踝关节组织巨噬细胞RAW264.7细胞中诱导ROS生成显著增加。桉树醇已经被报道在一些研究中发挥抗氧化作用。实验结果表明,桉树醇可降低msu诱导的RAW264.7细胞中ROS的生成,并可通过降低MDA的生成、恢复SOD和GSH的活性以及上调踝关节炎症组织中Nrf2的表达来发挥抗氧化作用。为了了解减少ROS是否能导致痛风条件下NLRP3炎症小体激活的抑制,我们研究了两种成熟的抗氧化剂NAC和Tempol在注射msu小鼠中的作用。最近有报道称,抗氧化剂可以在体外抑制MSU诱导的THP-1细胞系NLRP3炎症小体的激活和IL-1β的产生。我们发现,NAC和Tempol都能减少msu处理小鼠体内踝关节组织中MDA的过剩生成,并恢复内源性抗氧化剂,其程度与桉树醇相似。更重要的是,NAC和Tempol降低了msu注射小鼠的NLRP3炎症小体激活、IL-1β的产生和TRPV1通道过表达,与桉树精的作用类似。因此,我们的数据为桉树醇对msu诱导的痛风性关节炎的抗氧化作用提供了证据,并进一步提供了体内证据,表明桉树醇可能通过抗氧化作用机制抑制NLRP3炎症小体的激活。
我们发现,在msu诱导的痛风性关节炎的关节组织中,TRPV1通道的表达显著上调,这与之前的报道一致。TRPV1通道拮抗剂可减少msu诱导的痛风性关节炎关节液中的疼痛反应以及关节肿胀、血浆外渗、白细胞浸润和IL-1β的产生。TRPV1阳性感觉神经元的脱敏显著降低了msu诱导的痛风性关节炎的疼痛和关节水肿,表明TRPV1神经通道在介导痛风性关节炎的疼痛和炎症中发挥了关键作用。已经证实,TRPV1通道的表达可以通过一系列促炎细胞因子(包括IL-1β、IL-6和TNF-α)上调,从而导致疼痛的维持和加重。在这里,我们发现IL-1β、IL-6和TNF-α在msu处理小鼠踝关节组织中的表达均增加,这可能导致我们等观察到的TRPV1上调。此外,我们发现桉树醇治疗显著降低了踝关节组织中IL-1β、IL-6和TNF-α的过表达。通过抗氧化活性消除ROS可以降低NLRP3炎症小体的激活,从而减少IL-1β的释放。因此,这些影响可能导致在痛风条件下桉树醇表达TRPV1通道的衰减。
总之,我们提供的证据表明,桉树醇可以降低msu诱导的氧化应激、NLRP3炎症小体激活、促炎细胞因子的产生和TRPV1过表达。进一步证明桉树醇可减轻msu引起的疼痛和炎症,其机制可能与桉树醇的抗氧化作用有关。桉树醇和其他抗氧化剂可能代表有前途的治疗方案痛风关节炎的口服药剂。
参考文献
[1] Kaur, Gurcharn & Mohiuddin, Irshad & Aulakh, Jatinder Singh. (2017). An approach on phytochemistry and pharmacological studies of Eucalyptus globulus plant parts. 5. 1 - 9.
[2] Gooderham, Nigel & Guengerich, F. & Hecht, Stephen & Rietjens, Ivonne & Rosol, Thomas & Davidsen, Jeanne & Harman, Christie & Taylor, Sean. (2021). FEMA GRAS assessment of natural flavor complexes: Eucalyptus oil and other cyclic ether-containing flavoring ingredients. Food and Chemical Toxicology. 155. 112357. 10.1016/j.fct.2021.112357.
[3] Jiang Zhihui, Guo Xiao, Zhang Kunpeng, Sekaran Ganesh, Cao Baorui, Zhao Qingqing, Zhang Shouquan, Kirby Gordon M., Zhang Xiaoying.The Essential Oils and Eucalyptol From Artemisia vulgaris L. Prevent Acetaminophen-Induced Liver Injury by Activating Nrf2–Keap1 and Enhancing APAP Clearance Through Non-Toxic Metabolic Pathway.Frontiers in Pharmacology, 2019,10,doi.10.3389/fphar.2019.00782
[4] ChengyuYin,Boyu Liu,Ping Wang,Xiaojie Li,Yuanyuan Li,Xiaoli Zheng,Yan Tai,ChuanWang,Boyi Liu. Eucalyptol alleviates inflammation and pain responses in a mousemodel of gout arthritis. British Journal of Pharmacology, 2020, 177(9):2042-2057.