服务热线
177-5061-9273

乳香精油、没药精油和其熏香抵御神殿室内中的微生物。这是古人的智慧吗?
Milica LjaljevićGrbić , Nikola Unković, Ivica Dimkić,Peđa Janaćković, Milan Gavrilović, Olja Stanojević,Miloš Stupar, Ljubodrag Vujisić,Aleksa Jelikić, Slaviša Stanković,Jelena Vukojević
a University of Belgrade, Faculty of Biology, Institute of Botany and Botanical Garden “Jevremovac”, Takovska 43, 11 000 Belgrade, Serbia b Institute for the Protection of Cultural Monuments in Serbia, Conservation and Restoration Department with Physico-Chemical Laboratory, Radoslava Grujića 11, 11 000Belgrade, SerbiacUniversity of Belgrade, Faculty of Chemistry, Studentski trg 12-16, 11 000 Belgrade, Serbia

摘要 民族药物学相关性:从阿拉伯乳香和没药的树脂中提取出的精油分别俗称乳香和真没药精油,自公元前2800年以来,在传统医学中广泛用于治疗皮肤溃疡、伤口、牙齿、炎症和泌尿道疾病;用于制作木乃伊香膏和软膏;还有熏香和香水。自古以来,在宗教场所为精神目的和冥想而燃烧乳香和没药(在各种宗教中普遍存在)具有卫生功能,通过净化室内空气来净化气味和减少传染病。
研究目的:本研究的一般目的是评估乳香(B.carteri)和没药(C.myrha)精油和其熏香在液相和气相条件下的体外抗菌能力,以及测试其在调查过的17世纪建造的教堂环境中,用于净化被微生物污染的空气的原位抗菌活性有效性。
材料和方法:水蒸气蒸馏法提取乳香和真没药油树胶树脂,得到乳香和没药挥发油的化学成分采用GC-MS 测定,并采用微量肉汤稀释法和微大气扩散法评估其液相和汽相的抗菌性能。从二氯甲烷为溶剂的洗气瓶中获得烧熏香的烟气,采用气相色谱-质谱法进行化学分析,同时采用改进的微大气扩散法评估其抗菌活性,以评估其对真菌的发芽抑制和对细菌的CFU计数降低。分别在教堂的密封中殿和圣器室内评估了乳香熏香和精油气相的原位抗菌活性。
结果:乳香精油的主要成分为α-蒎烯(38.41%)和月桂烯(15.21%),而没药精油的特点是呋喃酮-1,3-二烯(17.65%)含量高,其次是莪术烯(12.97%)、β-榄香烯(12.70%)和大根香叶烯(12.15%)。熏香的烟雾和烟灰中的α-蒎烯(68.6%)和因香酚(28.6%)分别对应乳香和没药的最主要化合物。体外抗菌试验表明,细菌和真菌对精油的液相和气相以及熏香烟雾高度敏感。原位抗菌使用乳香精油的蒸汽和熏香的烟雾导致空气传播的活菌微生物分别减少45.39±2.83%和67.56±3.12%;真菌为80.43±2.07%,细菌(熏香)为91.43±1.26%。
结论:乳香精油是一种传统用途广为人知的化合物,其抗菌性能表明其作为天然抗菌剂具有明显的潜力。此外,研究结果表明,除了日常的教堂仪式外,在神圣的氛围中,也可以偶尔使用乳香精油挥发相和熏香烟雾作为空气净化的手段。
关键词:细菌;乳香;教堂;没药;真菌;树脂
1. 引言
微生物,包括古菌、细菌和真菌,以及地衣和害虫,由于其明显的生物退化潜力,不断给遗产古迹以及博物馆和私人艺术收藏中储存和展示的各类历史文物的保护带来诸多问题(Sterflinger和Piñar,2013)。为了修复最近或进行中的微生物损伤,目前可用的物理和化学方法范围有限(Allsopp等人,2004年)。使用液体杀菌剂或熏蒸进行的化学处理意味着使用欧盟杀生物产品指令(BPD)(欧盟编号528/2012)批准的少量合成杀生物剂。在选择用于控制遗产场所微生物污染的适当药剂时,有几个特点,例如显著的抗菌潜力、对附近人员的毒性最小或没有毒性、环境污染低风险,以及不干扰艺术作品的结构组件,必须加以考虑。从世界各地用于传统医学的植物中获得的天然产物(特殊代谢物),如精油(EOs),已知具有抗菌能力,尽管缺乏足够的科学证据,但被认为或多或少对人类无害。这促进了精油在医学、芳香疗法和各种形式的消费品中的全球应用(Lahlou,2004年;Camarda等人,2007年)。由于精油主要由各种类型的化合物组成,如萜烯类、萜类、醛类、醇类等,其中许多是挥发性的(Laird和Phillips,2011),它们代表了商业合成剂的天然替代品,因为微生物不太可能产生耐药性。

橄榄科乳香属和没药属的植物仅生长在阿拉伯半岛南部(也门和阿曼)、印度、马达加斯加、东北非洲、索马里、肯尼亚、埃塞俄比亚和苏丹的干旱地区,分别出产具有文化和商业重要性的乳香和没药的油树胶树脂(Baser等人,2003年;Hamm等人,2005年)。乳香和真没药最重要的来源是由硬化的芳香树脂渗出物大部分是天然获得的,或者是从乳香树和没药树树皮的切口中获得的。通过对这些树胶树脂进行水蒸馏获得的精油通常非常稠密,具有温暖、甜蜜和辛辣的气味(Mikhaeil 等人,2003)。
从历史上看,乳香和没药的使用可以追溯到公元前2800年,正如古埃及的医疗记录所述,乳香和没药被用作熏香和香水,以及制作木乃伊用的软膏和香膏。它们的联合使用在《纸草埃伯斯》中有很好的记载,这是一组约公元前1500年的处方,其中它们被用于治疗皮肤溃疡和伤口(Michie和Cooper,1991年)。因此,在撰写《圣经》时,乳香和没药是众所周知的,它们被广泛引用,被认为是最常提到的芳香树脂(De Rapper et al.,2012)。在基督教中,黄金、乳香和没药是圣诞节故事的关键部分,因为它们是三位智者(Balthasar, Melchior和Gaspar))送给婴儿耶稣的礼物(《马太福音》2:11,新约圣经)。过去,在寺庙和其他礼拜场所点燃乳香和没药会产生烟雾,用于通过净化空气来减少气味和传染(Michie和Cooper,1991年)。乳香、没药蒸气和油的抗菌特性早在公元前11世纪就已为人所知,当时苏美尔人用没药治疗牙齿和肠道寄生虫,而乳香的抗菌用途可追溯到公元11世纪,当波斯哲学家和医生阿维森纳使用乳香油治疗尿路炎症和感染时(Michie和Cooper,1991年)。如今,已经开展了大量研究,支持乳香和没药作为免疫增强剂、麻醉剂、抗过敏剂、抗炎剂、抗风湿剂、抗焦虑剂、抗抑郁剂、抗癌剂、抗氧化剂和抗菌剂的传统用途(Michie和Cooper,1991年;De Rapper等人,2012年;Shen等人,2012年)。

本研究的主要目的是评估熏香的体外和原位抗菌能力,以及通过水蒸气蒸馏法从乳香和真没药树脂中获得乳香和没药精油的液相和气相,以对抗从调查的教堂空气中分离出的细菌和真菌。
2.材料和方法
2.1.实验地点
Holy Ascension老教堂位于 Veliki Krčimir (Gornje Zaplanje, Gadžin Han, Serbia)村庄的苏瓦普兰尼纳山脉的西南坡上(北纬43°05′28′,东经22°12′40′)。它建于17世纪,由石灰砂浆制成的大块磨光石(siga)构成,代表着一个细长的半球形拱顶结构(6.5×12m),带有一个半圆形后堂,上覆山墙屋顶。沿着侧墙有一对壁柱,内部分为两个过道。教堂壁画的碎片,包括《旧约》和《新约》中的场景,大部分仍保存在中堂、祭坛区域和西立面(Deljanin,1995年)。目前,尼什文化遗迹保护研究所的一项指令(SK305,“RS官方公报”第28/83号)将该教堂列为一个非常重要的文化遗迹。
2.2.试验微生物分离株
2.2.1.真菌分离株和培养条件
以下真菌分离株用于测定精油和熏香烟雾的体外抗真菌效率:黄曲霉(BEOFB 313m)、黑曲霉(BEOFB 343m)、欧洲曲霉(BEOFB 381m)、枝状枝孢菌(BEOFB1821m)、夏孢生 枝孢菌(BEOFB 1841m)、澳大利亚弯孢霉菌(BEOFB 713M)、比莱青霉(BEOFB1131m),羊毛状青霉菌(BEOFB 1161m)和阿托血球青霉菌(BEOFB 1171m)。本研究中使用的真菌为腐性或致病性/产毒物种,分布于世界各地,主要为空气传播和小孢子(Florian,2004),从调查的教堂空气中获得(Unković等人,2017年),并通过ITS的I和β-微管蛋白基因测序确定。分离株保存在低温瓶中,温度为1.5毫升30%甘油− 75°C(ViVar等人,2013)沉积在贝尔格莱德大学真菌培养所-生物学院(BEOFB)。分生孢子悬浮液(1.0×105 CFU /mL)根据Unković等人(2018)中给出的方案制备,并储存于−20℃。试验前,将稀释的接种物培养在固体MEA上,以检查其有效性并验证是否存在污染。
2.2.2. 细菌分离株和培养条件
使用空气采样器(MAS-100 Eco,Merck)从调查教堂的空气中获得细菌分离株,气流设置为100 L/min。使用BHI(脑心输液,Lab M)和TSA(胰蛋白酶大豆琼脂,Merck)生长培养基培养细菌。分离株在30℃有氧培养24小时。在形态学分析和革兰氏反应的基础上,考虑对23株细菌进行进一步分析。将悬浮液调整至麦克法兰标准浊度(0.5)(BioMérieux,Marcy-lÉoile),相当于约1.0×108CFU /mL。
对于分离株的分子鉴定,根据Dimkić等人(2013)所述程序的修改版本分离基因组DNA。在13000 rpm下离心过夜培养物5分钟后,细胞重新悬浮,并在37℃下在含有200µg /mL溶菌酶(Serva GMBH)的500µL裂解缓冲液(TE,pH 7.6;50 mM TRIS;1 mM EDTA)中培养30分钟,用于革兰氏阳性分离株,或在500µL的TE缓冲液中加入0.5%的十二烷基硫酸钠(SDS)和100µg/mL蛋白酶K(Sigma-Aldrich)作为革兰氏阴性分离株。离心(13000rpm,5分钟)后,在500µL TEN洗涤缓冲液(50 mM TRIS,pH 8;10 mM EDTA,pH 8;50 mM NaCl)中洗涤颗粒,然后添加250µL 2%十二烷基硫酸钠和250µL苯酚-氯仿。离心步骤(13000 rpm,10分钟)后,收集上层水相,进一步的分离步骤包括添加1/10体积的3 M醋酸钠(pH 4.8)和1体积的异丙醇。将混合物离心(13000 rpm,15分钟),通过乙醇沉淀法回收DNA,并将其溶解在含有1µL RNA酶混合物(10 mg/mL)的50µL TE缓冲液中。
从PCR扩增片段中确定了所选菌株的16S rRNA基因序列。使用通用引物UN116sF(GAGAGTTGGC)和UN116sR(AGGTGCG)扩增16S rRNA基因(1500 bp)。在30µL含有1.5µL模板DNA的反应混合物中进行PCR扩增;2.4µL 25mM氯化镁(KAPA生物系统);3µL 10×KAPA-Taq缓冲液(KAPA生物系统);0.6µL dNTP(每种10mM)混合物;每种底层涂料1.2µL;1.5µL Taq聚合酶(KAPA生物系统);和19.95µL无核酸酶水(Gibso)。PCR反应在94℃下进行5分钟的初始变性步骤,然后在94℃下进行30秒的30个循环,在50℃下进行1分钟的引物退火,并在72℃下延长30秒,然后在72℃下进行最后的延长步骤,持续7分钟。使用QIAquick PCR纯化试剂盒KIT/250(QIAGEN GmbH)纯化PCR产物,并将其发送至荷兰的Macrogen测序服务机构进行测序。获得的序列与GenBank数据库(国家生物技术信息中心Blast搜索工具)中先前测序的基因进行同源性搜索,最相关的菌株类型序列用于系统发育分析。所有序列均使用在BioEdit 7.2.6中实现的Clustal W多序列比对进行比对,并使用基于成对距离矩阵的邻接法和Kimura双参数核苷酸替换模型在MEGA 6中构建系统发育树。采用1000个重复的独立重采样方法对系统树的拓扑结构进行了评估。
2.3. 植物材料
乳香和没药油树胶树脂(www.theplantlist.org;15.11.2017)是NOP(国家有机项目)和VOF(佛蒙特州有机农场主)认证的商业样品(批号BC000103和CM000102),从伊斯梅尔进口有限责任公司(Burlington, Vermont)获得,最初在索马里兰共和国收获得到(http://www.boswellness.com/products/)。
2.4. 生物杀菌剂
从塞尔维亚文物保护研究所获得了50%(v/v)的苯扎氯铵(BAC)水溶液。在实验之前,在无菌去离子水中稀释杀菌剂,以制备最终浓度为3%(v/v)的储备溶液。
2.5. 精油的分离
根据《欧洲药典》中所述的程序,使用克利文杰型仪器,通过水蒸气蒸馏3小时,从油树胶树脂(65.00 g)中分离精油(欧洲药典,第6版,2007年)。这些油在4℃的黑暗中储存,直到进一步分析。
2.6. 燃烧熏香和提取烟雾和烟灰
使用专门为此目的设计的设备燃烧熏香和提取烟雾和烟灰。将乳香油树胶树脂(约5.00 g)放在木炭块上,放在真空干燥器中的石棉网上燃烧,并在真空泵的帮助下将烟雾转移到Drechsler瓶中,在溶剂水平下进行气体清洗。二氯甲烷用于萃取。此外,部分烟雾以烟尘的形式沉积在真空干燥器龙头的挂钩上,并使用超声波浴用二氯甲烷萃取。样品,即溶解在二氯甲烷中的烟雾和烟灰,用于GC-FID和GC-MS分析。在相同条件下进行分析,不使用油树脂燃烧的木炭块用作阳性对照。
2.7 气相色谱/质谱(GC-FID和GC/MS)分析
GC-FID和GC/MS分析使用安捷伦7890 A仪器进行,该仪器配备5975 C质量选择检测器(MSD)、火焰离子化检测器(FID)和HP-5 MSI熔融石英柱(柱长30 m,直径0.25 mm,膜厚0.25 mm)。烘箱温度线性编程,以3℃/min的速度从60℃上升到240℃;注射器温度为220℃;探测器温度为300℃;传输线温度为240℃。载气为He(210°恒压模式下为1.0 mL/min),进样量为1μL,分流比为10:1。电子碰撞质谱(EI-MS;70 eV)是在40–550m/z范围上获得的。使用NIST AMDIS(自动质谱去卷积和识别系统)软件(版本2.64.113.71)进行库搜索和质谱去卷积和提取,保留指数(RI)校准数据分析参数设置为强水平,没有RI的化合物将受到10%的罚函数法。RIs的实验测定采用标准方法,包括在相同色谱条件下注入精油后的正构烷烃保留时间(tR)。搜索是针对我们自制的图书馆进行的,其中包含4972个光谱。根据GC峰面积计算鉴定化合物的相对含量。使用文献中的数据确定并比较评估了库中未发现的化合物。(Brieskorn and Noble,1982、1983a、1983b;Wahab等人,1987年;Dolara等人,1996年;Hamm等人,2005年;Mohamed等人,2014年)
2.8.体外抗菌活性测定
2.8.1 Broth微稀释试验
使用96孔微量滴定板(F-bottom,Ratiolab),通过连续稀释技术(Hanel和Raether,1998)测定精油液相的最低抑菌浓度(MIC)和最低杀真菌浓度(MFC)。不同体积的精油,以及3:1比例的乳香和没药精油的混合物,溶解在麦芽提取物肉汤(MEB)中,每孔10µL分生孢子悬浮液,以达到所需的精油浓度范围在0.1至200 mg/mL。微滴定板在25±2℃(UE500,Memmert)下培养72小时。MIC值被确定为使用双目显微镜(Stemi DV4,蔡司)观察到的无明显生长的最低浓度。没有可见生长的最低浓度被定义为MFC值,表明原始接种物的杀灭率为99.5%,这是通过在每孔含有100µL MEB的微滴定板上连续移种2µL,并在25±2℃下进一步培养72小时来确定的。BAC被用作阳性对照。
对于细菌分离株,使用微量肉汤稀释法(Dimkić等人,2016年)测定MIC和最低杀细菌浓度(MBC)。第一个培养皿中精油的最终浓度为2 mg/mL使用MHB(Müller Hinton肉汤,HiMedia)进行两次连续稀释,所有稀释均为三次。甲醇作为溶剂的最终浓度为10%。除了阴性对照和无菌对照外,还将抗生素链霉素、氨苄西林和利福平(Sigma-Aldrich)作为阳性对照进行了检测。除无菌对照外,每孔均接种20µL细菌悬液(McFarland 0.5),最终体积为每孔200µL。最后,加入22µL Resazurin溶液(最终浓度为0.675 mg/mL向所有孔中加入Resazurin钠盐C12H6NNaO4,TCI),并在30℃下培养24小时。Resazurin是一种用于评估细胞生长的氧化还原指示剂。它是一种蓝色、无荧光、无毒的染料,在活细胞内被氧化还原酶还原为Resorufin时会变成粉红色和荧光(Sarkeret al.,2007)。颜色没有变化的最低浓度被确定为MIC值。此外,通过在Müller-Hinton琼脂平板上无颜色变化地对每个孔中的试验稀释液进行二次培养并培养18–24小时来确定MBC。未显示细菌生长的最低浓度被定义为MBC值。结果以mg/ mL表示。
根据鉴定结果和获得的MIC值,选择了15株细菌(MK 1.5、MK 2.1、MK 2.3、MK 2.4、MK 2.7、MK 3.2、MK 5.3、MK 5.4、MK 6.3、MK 7.1、MK 7.2、MK 8.1、MK 9.1、MK 9.3和MK 9.4)来检测乳香和没药的精油之间的相互作用类型(棋盘法,Schwalbe et al.,2007)。在两个单独的平板上分别对EOs进行两次连续稀释,浓度范围为1.0至0.03 mg/mL。在一个平板上混合微孔内容物,并测试所有36种可能的浓度组合。与MIC分析一样,向每个孔中添加20μL的细菌悬浮液(包括细菌生长控制),使每个孔的最终体积达到200μL。最后,向每个孔中添加22μLResazurin。在30°C下培养24小时后,颜色没有变化的最低浓度再次被定义为特定精油组合的MIC值。测定了所有油的组合的协同作用、相加作用、无差异性或拮抗作用。单个油和不同油组合的MIC通过以下方式转化为部分抑菌浓度(FIC):
化合物A的FIC=化合物A在化合物B存在下的MIC/化合物A的MIC
化合物B的FIC=化合物B在化合物A存在下的MIC/化合物B的MIC
根据每种油的FIC值计算出的分级抑制浓度指数(FICi)如下:FICi=FICA+FICB
其中,A表示乳香精油,B表示没药精油。FICi解释为:FICi≤0.5时表示协同效应;FICi>0.5-1时表示加性效应;1<FICi≤4时表示显著效应;FICi>4时表示拮抗效应(van Vuuren 和 Viljoen,2011)。
2.8.2.微大气法
通过Maruzella和Sicurella(1960)的微大气扩散生物测定法的改进版本,确定了乳香挥发油的挥发性阶段诱导的分生孢子萌发抑制。试验在含有5mL MEA的皮氏培养皿(Ø50mm)中进行。在培养基中心,注入30μL体积的分生孢子悬浮液,然后翻转培养皿。用不同体积的精油(最终浓度为4、6、8、10和12 mg/cm3)浸泡的无菌滤纸盘(Ø1 mm)被放置在培养皿盖的中心。皮氏培养皿在25±2°C下培养24小时。培养期结束后,接种皿的中心用乳酚棉蓝(LCB)染色,放置盖片,使用蔡司AxioImagerM1光学显微镜和AxioVision Release 4.6软件观察和测量随机选择的分生孢子的芽管。所有测量均一式三份,并以平均值±标准偏差表示。
用同样的方法研究了菌丝体和分生孢子对熏香烟雾的敏感性。为此,将含有5mL MEA的两套三份皮氏培养皿(Ø50mm)分别接种羊毛状青霉菌和澳大利亚弯孢菌的分生孢子和菌丝体悬浮液。将接种的皮氏培养皿放置在旁膜密封玻璃容器(空气体积为2700 cm3)中30分钟,在此期间,在木炭煤块上连续燃烧5.00 g乳香油树胶树脂。对于分生孢子萌发试验,培养皿在25±2°C下培养24小时,而菌丝生长试验在25±2°C下培养7天。在24小时的潜伏期后,以上述相同的方式测定分生孢子萌发抑制。另一方面,通过测量培养7天后的菌落直径来监测菌丝生长动态。使用Pandey等人(1982)的公式计算菌丝生长抑制率(%):
抑制菌丝生长(%)=100(dc-dt)/dc
其中,dc为对照组的真菌菌落的平均直径,而dt为熏香烟气处理后的真菌菌落的平均直径。
此外,还测试了乳香精油的气相和熏香烟雾的抗菌活性。在这两种检测中,对于所选的17种细菌分离株中的每一种,将100μL最佳稀释的细菌过夜悬浮液分四次接种在MHB琼脂平板表面。用360μL或180μL精油(分别为12 mg/cm3和6 mg/cm3)浸渍滤纸盘(Ø10 mm)放置在培养皿盖上(Ø85 mm),而对照组缺少精油。对于涉及香熏的分析,将接种有细菌最佳稀释液的MHB琼脂板置于玻璃容器中,并将其暴露于木炭煤上燃烧香熏(5.00 g)中30分钟,在此期间,容器用封口膜密封。在这两种分析中,培养板在30°C下培养48小时,CFU/mL计算对照菌株和处理菌株的。
2.9 原位抗菌活性
使用符合教堂环境的芳香气味室,研究了乳香精油和熏香烟雾的原位抗菌潜力。圣器室(墙壁上的壁画孔,尺寸:40(宽)×55(高)×32(深)厘米)用于模拟原位条件和测试精油。在实验之前,通过被动沉降法(Omelyansky,1940)估计了圣器室空气中的微生物污染水平。将富含链霉素的MEA和M40Y(麦芽酵母40%蔗糖琼脂)和MHA(Müller Hinton琼脂)的复制培养皿(不含和含有制霉菌素(MHA+N))置于圣器室中,并暴露于正常气流中30分钟,以分别分离真菌和细菌。6小时后进行原位处理,在此期间,正常的日常活动和气流允许重新建立空气微生物群的含量。在这段时间之后,在环境温度(24.8±0.14°C)和相对湿度(41.65±0.49%)的条件下,将2mL的乳香精油在圣器室中蒸发30分钟,同时使用开放式的MEA、M40Y、MHA和MHA+N皮氏培养皿。圣器室用聚乙烯板密封在涂层塑料框架上,立即设置精油和皮氏培养皿,从而形成一个芳香氛围(用饱和精油)。在实验室条件下,预防接种的皮氏培养皿在25±2°C下培养7天,然后计数生长的真菌和细菌菌落。每立方米空气的CFU数(CFU /m3)根据Omelyansky(1940)公式估算:
N =5a x 10 4(bt) -1
式中,N为真菌/细菌CFU /m3,a为每个培养皿的真菌/细菌菌落数,b为培养皿表面(cm2),t为暴露时间(min)。
为了评估熏香烟雾的原位抗菌能力,重复了实验,但有几个不同之处:(1)熏香在带有密封窗户和门的中殿燃烧,以防止意外气流,并允许形成芳香氛围;(2) 将约5.00 g树脂放在木炭煤块上,燃烧至自熄;(3) 在烟雾处理前后,使用MAS-100生态空气采样器(100L-min−1)对空气中的真菌和细菌进行采样;(4)根据Feller(1950)校正真菌和细菌菌落计数值,并乘以10,表示为CFU /m3。
2.10 统计分析
获得的数据进行方差分析(ANOVA)和分离使用乳香的气相和熏香进行处理时的平均值CFU/mL。除此之外,还使用Tukey的HSD测试分析了不同浓度的乳香精油和苯扎氯铵挥发物对分生孢子萌发的抑制百分比。在P<0.05时,这些值被认为是显著的。所有稀释液分四次重复测试,重复两次。采用统计学的一般程序进行统计分析版本7(StatSoft,Inc.)和IBM SPSS统计软件版本20(SPSS公司)。
3.结果和讨论
3.1精油的化学成分
乳香和没药油树胶树脂的精油[产率分别为2.28%和0.32%(w/w)]透明且有强烈的气味。通过GC-FID和GC-MS分析,检测到57种化合物(98.99%),其中56种被鉴定出,占乳香精油的98.84%(痕量中发现10种化合物)。另一方面,在没药精油中发现了40种化合物(98.87%),其中37种被鉴定出,占挥发油的98.19%(痕量中发现了2种化合物)。表1按洗脱顺序列出了所有化合物。乳香精油中以单萜烯类为主(87.51%),而没药精油中以倍半萜烯类为主(58.76%)。乳香精油以占比极高的α-蒎烯(38.41%)和月桂烯(15.21%)为特征成分,其次是香桧烯(12.13%)和柠檬烯(6.24%)。没药精油中最主要的化合物是莪术呋喃-1,3-二烯(17.65%),其次是莪术烯(12.97%)、β-榄香烯(12.70%)、大根香叶烯B(12.15%)、大根香叶烯D(9.13%)、大根香叶烯A(5.87%)和香樟烯(5.34%)。
结果表明,乳香精油富含单萜烯类化合物(88.73%),而没药精油富含倍半萜烯类化合物(58.76%)。另一方面,乳香精油的倍半萜烯类化合物含量较低(7.53%),而没药精油的单萜烃含量较低(0.34%)。众所周知,挥发精油的定量和定性组成决定了精油的特性,即反映在它们的抗菌活性上(Laird和Phillips,2011;Ali等人,2008)。此外,精油的化学成分取决于植物的基因型,以及各种环境因素,如气候、收获时间和储存条件(Mejri等人,2010年;De Rapper等人,2012年)。到目前为止,已经对乳香精油的组成进行了大量研究,单萜烯类化合物通常被报道为主要化合物(Baser等人,2003年;Camarda等人,2007年)。在我们的工作中,乳香精油的组成与早期对索马里乳香精油进行的研究结果具有可比性。几种化合物的存在明显相似,如α-蒎烯、香桧烯、柠檬烯、α-侧柏酮和对伞花烃(Abdulwahab等人,1987年;Chiavari等人,1991年),而在Wang等人(1993年)的研究中,乙酸辛酯和辛醇占主导地位。月桂烯是所研究的精油中的主要化合物之一,因此月桂烯的含量存在差异,但总体而言,月桂烯的含量相较于其他组分更高。
所研究的没药精油的特征是倍半萜烯类含量高(58.76%),含氧倍半萜烯含量也相对较高(38.25%)。早期的研究也表明,没药油的特点是倍半萜的烯烃化合物和含氧倍半萜的含量高,但不含单萜烯烃化合物(Abegaz et al.,1989)。报道的主要成分包括α-榄香烯、7-异丙基-1,4-二甲基-2-泽泻醇、莪术烯、大根香叶-1(10)7,11-三烯-15-油酸、8,12-环氧-6-羟基-ç-内酯、δ-榄香烯、δ-新丁香烯、大根香叶烯B和佛术烯(MortezaSemnani和Saeedi,2003)。此外,Marongiu等人(2005年);Baser等人(2003年)表明,埃塞俄比亚的没药精油的主要化合物为莪术呋喃二烯-1,3-二烯、呋喃二烯、莪术烯、香樟烯和α-榄香烯。其中,莪术呋喃-1,3-二烯、莪术烯、δ-榄香烯、香樟烯和大根香叶烯B都是在我们的研究和上述研究中发现的化合物。

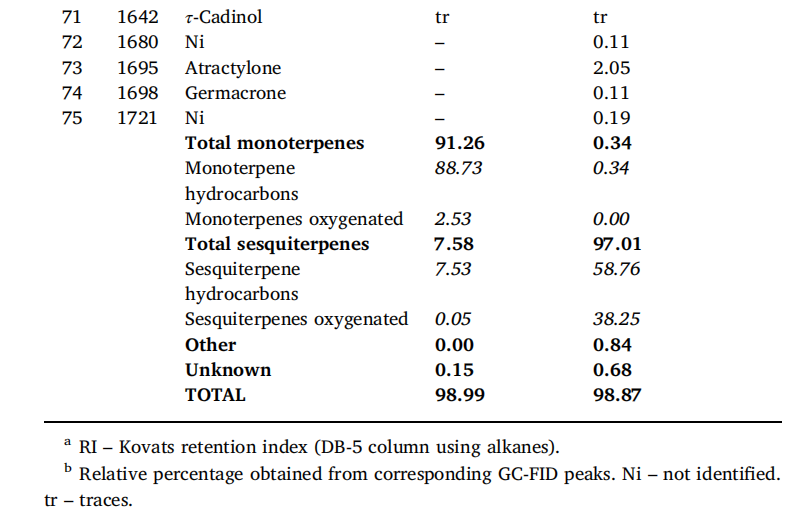
3.2. 熏香烟雾和烟灰中的化学成分
通过GC-FID和GC-MS分析,(乳香油树脂)熏香的烟雾和烟灰中共含有34种化合物。在烟雾中检测到12种化合物(100%),22种化合物(99.9%)。在22种烟灰化合物中,有2种(99.0%)被鉴定出来。表2按洗脱顺序列出了所有化合物。结果表明,香熏烟雾中以单萜烯烃为主(99.4%)。此外,烟雾的特征成分是占比极高的α-蒎烯(68.6%),其次是香桧烯(9.9%)和α-侧柏烯(7.0%)。在熏香烟灰中,含氧二萜类化合物占主导地位(47.3%),其次是三萜烯类化合物(25.3%)、二萜烯类化合物(10.2%)和倍半萜烯类化合物(7.2%)。香熏烟灰化合物中最主要的化合物是因香酚(28.6%),其次是异因香酚(18.7%)、24-降乌苏-3,12-二烯(9.1%)、24-降乌苏-3,9(11),12-三烯(6.4%)和新松柏烯(5.7%)。燃烧没有任何化合物的木炭煤作为阳性对照,在相同条件下进行分析。

据我们所知,之前只有两次尝试分析熏香烟雾的化学成分,而此处首次使用第2.6节中所述的方法测定残余烟灰的化学成分。Pailer等人(1981a、1981b、1981c)通过真空蒸馏从乳香树脂的乙醚提取物中收集热解产物;然而,这些研究的结果并不适用,因为条件不同于日常教会仪式中观察到的情况。另一方面,Basar(2005年)的研究结果与本文所述的结果具有可比性,因为在这两种情况下,烧香的方式与教堂中烧香的方式相似。据报道,通过固相吸附测定,并通过GC和GC-MS研究,在红热木炭上燃烧乳香树脂所形成的烟雾由因香酚(22.8%)、乙酸因香酯(15.5%)、乙酸辛酯(10%)、轮状聚伞花-4(20),7,11-三烯(9.3%)、1-辛醇(4.0%)、松柏烯A(3.7%)和松柏烯 C(1.5%)(Basar,2005年)。尽管在烟灰中检测到了因香酚(28.6%;最主要的化合物)和松柏烯A(2.5%),但我们研究的烟雾中没有所报道的化合物。我们的研究与Basar(2005)的研究有相似之处,α-蒎烯是乳香精油和熏香烟雾中的主要化合物;但烟雾中含量更高(68.6%)。香桧烯也是主要化合物之一(9.9%)。另一方面,烟灰中主要是含氧二萜类化合物,而精油和烟雾中缺少这类特殊的代谢物。这是因为二萜是植物树脂不可分割的一部分,这是因为它们的化学结构和物理特性(较大的分子具有较高的分子量),这使得它们具有较高的沸点和较低的氧化速率,并有利于植物树脂粘性的形成。在其他地方,已经证明24-降乌苏-3,12-二烯(24.45%)和因香酚(22.55%)是乳香油树胶树脂的主要化合物(Ammar等人,2013)。我们还发现因香酚(28.6%)和24-降乌苏-3,12-二烯是乳香烟灰的主要成分。
3.3. 真菌对精油液相的敏感性
表3总结了八种致病和产毒真菌分生孢子期的乳香精油和没药精油的MIC和MFC值。在微量肉汤稀释法中,高MIC值(12.5–150 mg/mL)和MFC值(25-185.5mg/mL)表明,没药精油的抗真菌活性较低。欧洲曲霉是最易受没药精油处理得到的分离株,当浓度为25 mg/mL时,这种真菌的生长完全受到抑制。另一方面,最具耐药性的分离株是比莱青霉。迄今为止的几项研究已经证实,酵母菌,即白色念珠菌、新型隐球菌和酿酒酵母,对没药精油的液相敏感(De Rapper等人,2012年;Mohamed等人,2014年)。到目前为止,只有Prakash等人(2012年)报告了各种丝状真菌的敏感性,这也是本次研究的主题。上述研究展示了没药精油对九种食源性霉菌的体外抗菌研究结果,其中包括黄曲霉、黑曲霉和枝状枝孢菌。对于给定的分离株,同样通过微量稀释法测定的MIC值在2.5至3.5µL /mL的范围内。不幸的是,由于这种油的产量极低(0.32%),因此没药精油在原位抗菌的能力缺乏成本效益,因此无需进一步考虑。
与没药精油相比,乳香精油的液相抗真菌活性显著增强。对于大多数分离株,两种受试精油之间的MIC和MFC值存在显著差异,最显著的是枝状枝孢菌和夏孢生枝孢菌。一般而言,MIC值和MFC值的范围为10至120 mg/mL用于测试的微真菌。黄曲霉被证明是最具耐药性的分离株,其MIC和MFC值为120 mg/mL。另一方面,最敏感的真菌是球孢枝孢菌(MIC和MFC值为10 mg/mL ),以及枝状枝孢菌和羊毛状青霉(MIC分别为10 mg/mL和30 mg/mL )。受试枝孢菌分离株的显著敏感性对于乳香精油原位抗菌应用的潜力尤其重要,因为通过扫描电镜观察到,在Holy Ascension老教堂壁画的高度退化区域,枝孢菌样生殖结构在地下大量存在(Unković等人,2015b,2016)。虽然通常具有更强的抗真菌活性,但乳香精油对阿托血球青霉、羊毛状青霉和欧洲曲霉的作用略弱于没药精油。与没药精油相比,乳香精油的抗真菌活性得到了更大程度的研究,之前的研究均匀地集中在酵母和丝状真菌对精油处理的敏感性上(Prakash et al.,2014)。基于其高产率(2.28%)和低MIC和MFC值,选择乳香精油作为进一步研究原位抗菌应用的合适候选物。从Boswellia油树胶树脂中分离得到的精油其抗真菌活性来自于柠檬烯、芳樟醇和α-松油醇(Carson and Riley,1995;Pattnaik等人,1997;Aggarwal等人,2002),这些化合物也存在于本文研究的精油中。
乳香和没药精油以3:1的比例混合,与各自的油相比具有更强的抗真菌活性(表3)。记录的MIC和MFC值范围为4至100mg/mL对治疗最敏感的真菌是夏孢生枝孢菌(MIC和MFC为4 mg/mL) 其次是枝状枝孢菌(MIC为4 mg/mL)和10 mg/mL的MFC−1)和欧洲曲霉(MIC为4mg-mL−1和MFC20mg/mL) 另一方面,黄曲霉的MIC和MFC值为100 mg/mL,是最不敏感的分离株。混合精油显示出协同作用(枝状枝孢菌和夏孢生枝孢菌)和添加剂(欧洲曲霉和比莱青霉)特性,未观察到拮抗作用。对于其余的受试曲霉菌和青霉菌,精油之间没有相互作用的记录。
在肉汤稀释法中,所有研究精油的抗真菌活性潜力表现得比阳离子表面活性季铵盐化合物BAC弱,BAC用作阳性对照。对于这种商用杀菌剂,MIC和MFC值在0.15至0.75 mg/mL范围内(表3)。黑曲霉和羊毛状青霉最易受BAC处理的影响,在0.15mg/mL浓度下达到杀菌效果,而最具耐药性的菌株是欧洲黑曲霉和黄曲霉(MIC和MFC为0.75 mg/mL ). 这种由低浓度的BAC引起的分生孢子萌发损失与关于这种氮基杀生物剂抗真菌活性的已发表数据完全一致(Tortorano等人,2005年;Vijayakumar等人,2012年;Xu等人,2013年;Unković等人,2015a)。通过对碱性季铵盐化合物的配方进行各种修改而产生的许多杀菌剂产品,被BPD批准用于保护文化遗产古迹,因为它们相对环保(Cooke,2002),并且经常用于保护壁画(DiazHerraiz et al.,2013)。然而,Scheerer等人(2009年)建议限制使用氮基杀菌剂,因为一些微生物团体可以将其用作氮源,因此有利于再融合。此外,持续使用相同的杀菌剂可导致受试微生物的敏感性降低,这一趋势已在BAC中得到报道(To等人,2002年;Langsrud等人,2003年)。尽管精油通常效果较差,但由于其可生物降解的性质,以及精油本质上代表了多种协同作用的主要和次要成分的混合物,因此预计精油比合成杀菌剂更有优势,从而最大限度地降低耐药真菌菌株发展的可能性(Saxena和Mathela,1996年;Shaaban等人,2012年)。
3.4. 真菌对精油气相的敏感性
Maruzella和Sicurella(1960)描述的标准化微大气方法最初是为了阐明菌丝体对受试制剂蒸汽的敏感性,在芳香氛围中形成的真菌菌落直径被视为判断抗真菌活性的标准(Lang和Buchbauer,2012)。然而,由于空气传播的分生孢子是文化遗产的主要污染源之一,因此决定测试所选精油的气相部分对分生孢子萌发的影响。图1显示了由乳香精油气相阶段诱导的分生孢子萌发抑制百分比。在所有受试精油浓度下,在枝状枝孢菌和夏孢生枝孢菌中观察到完全抑制分生孢子萌发(100±0.0%),从而证实了通过微量肉汤稀释法得到的这些分离株对乳香精油的显著敏感性。在最大试验浓度(12 mg/cm3)下,对羊毛状青霉(99.38±1.6%)、比莱青霉(95.37±1.6%)和欧洲黑曲霉(100.0±0.0%)也有相同的分生孢子萌发抑制作用,但没有统计学上的意义。在最高精油浓度下观察到对黑曲霉的最佳抑制(66.71±1.51%),而在相同浓度下观察到对阿托血球青霉菌和黄曲霉的无统计学意义的活性。虽然Udomsilp等人(2009年),但之前还没有用这种方法研究过真菌对精油气相的敏感性;Ljaljević Grbić等人(2011年)研究了与药用植物中的精油接触对几种食源性真菌孢子萌发的影响,以及从尼泊尔海棠叶表面和种子中分离出的真菌,而Stupar等人(2016年)则证明了乳香精油的气相部分对从文化遗产中分离出的真菌菌丝体的中度抗真菌作用。
我们的研究结果与最近公布的数据一致,这些数据强调精油的气相比液相更有效,因为它们在较低浓度下具有更强的活性,并且由于其挥发性可用于更广泛的环境,例如作为空气去污剂(Laird and Phillips,2011)。我们的结果与Inouye等人(2006年)的结果一致,他们证明,对于由醇、酮、酯、氧化物和碳氢化合物组成的精油,主要的抑制作用来自蒸汽。有人认为,气相的较高抗菌潜力是由于液相中亲脂性分子的结合,从而形成胶束并抑制精油附着到微生物上,而气相允许组分自由附着并插入细胞膜富含脂质的部分,从而破坏了它的功能(Inouye等人,2000和2003年)。尽管如此,与大量证据表明精油液相的有效性相比,精油气相的抗菌潜力研究相对较少,尽管它最近尤其是在文化遗产保护领域,受到了越来越多的关注。
在相同浓度的杀菌剂(12 mg/cm3)下记录了羊毛状青霉菌对分生孢子萌发抑制作用的比率为(77.27±2.59%),其次是欧洲曲霉(72.32±2.57%)和枝状枝孢菌(72.43±3.93%)。在最高浓度的杀菌剂下,夏孢生枝孢菌和比莱青霉菌的活性在统计学上不显著。较低浓度的杀菌剂,4和6mg/cm3,在黑曲霉和枝状枝孢菌中没有表现出对分生孢子萌发的抑制,而黄曲霉在所有研究浓度下都具有完全抗性。两次应用分析结果之间的差异可归因于杀菌剂与微大气中的分生孢子缺乏紧密接触,液相和杀菌剂挥发性部分的作用机制不同,或者在环境温度下BAC的蒸发率显著降低。

图1. 不同浓度(mg/cm3)的乳香精油和苯扎氯铵(BAC)气相部分对分生孢子萌发的抑制程度(%)。同一字母后各测试浓度内的不同抑制方式无显著性差异(Tukey的HSD试验,P<0.05)。分生孢子萌发抑制率的平均值和标准误差如图所示。
3.5. 熏香烟雾的抗真菌潜力
采用改进的微大气扩散法,在两种选定的微真菌上评估了菌丝体和分生孢子对烧香烟雾的敏感性:具有小球形分生孢子的羊毛状青霉;澳大利亚银鱼状枝孢菌,一种真菌代表并具有大的黑色素化多节分生孢子。在这两种处理过的菌株中,菌丝体对熏香烟雾的敏感度相同,对羊毛状青霉的生长抑制率为47.27±2.29%,对澳大利亚银鱼状枝孢菌的生长抑制率为44.75±1.51%。除了较小的菌落直径外,培养物中未观察到其他形态生理学变化。
经过30分钟的烟雾处理,羊毛状青霉分生孢子的萌发完全受到抑制(100±0.0%),而澳大利亚银鱼状枝孢菌的萌发受到高度抑制(92.65±1.56%),其特征是出现了长度为10.78±2.13µm的微小芽管。在后者中,由于机械和化学影响,从烟雾中排出的一层薄薄透明的蜡状层阻碍了芽管的正常形成和菌丝生长。大分生孢子具有终末萌发和强健的菌丝,是观察点燃熏香烟雾诱导的抑制作用的理想材料。这些结果表明,精油的抗菌性能也存在于熏香中(以α-蒎烯为主的化合物,在两种菌中分别占38.41%和68.6%),这表明需要进一步研究。
3.6. 细菌分离与系统发育分析
通过形态学分析和革兰氏反应,选择了23株空气中的细菌菌株,并用于进一步的分子鉴定。根据BLASTn分析,基于16S rDNA,至少有15种不同的物种被确认存在。基于菌株MK 2.1和MK 3.2核苷酸序列的相似性,系统发育重建将它们与沙芬西芽孢杆菌NBRC 100820(NR_113945)和短小芽孢杆菌NBRC 12092(NR_112637)联系起来,具有相同的识别率(99.5%)。然而,Bootstrap共识树(数据未显示)表明,分离株MK 2.1与短小芽孢杆菌更相似。分离株MK 1.3、MK 1.4、MK 6.3和MK 7.2也获得了类似的结果,这些分离株被鉴定为藤黄微球菌NCTC2665(NR_075062)或芦荟微球菌AE-6(NR_134088)。进行的BLASTn分析表明,MK 7.2更可能是芦荟微球菌(最高和总分:2122;查询覆盖率:99%,E值:0.0;缩进率:99.4%)。此外,一些分离株被归类为单纯芽孢杆菌LMG11160(NR_114919)(MK 1.1、MK 2.5、MK 4.1和MK 9.3);或污染芽孢八叠球菌CCUG 53915(NR_116955)(MK 1.2、MK 2.7、MK 3.6和MK 6.1)。在系统发育分析中,其余的分离株形成了一个由高Bootstrap值支持的单一分枝,这些分离株与来自相同或其他属的物种最为相似,如图2所示。
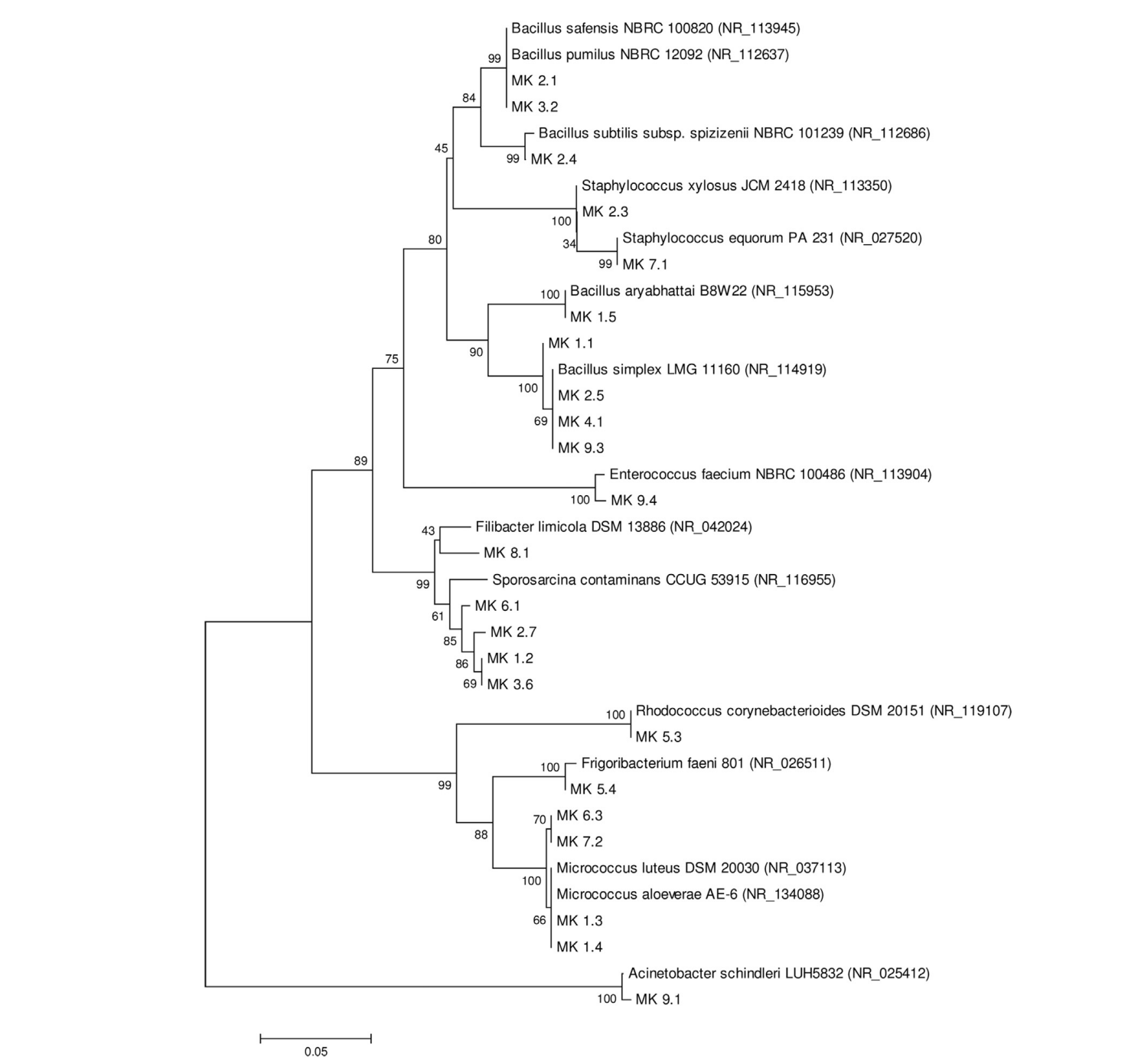
图2. 基于16个S rDNA序列(1500 bp)的邻接系统发育树显示了23个受试菌株与相关参考菌株之间的关系。大于50的引导值(以1000次重复的百分比表示)将显示在分支点。每条线表示遗传距离为0.05。
3.7. 细菌对精油液相的敏感性
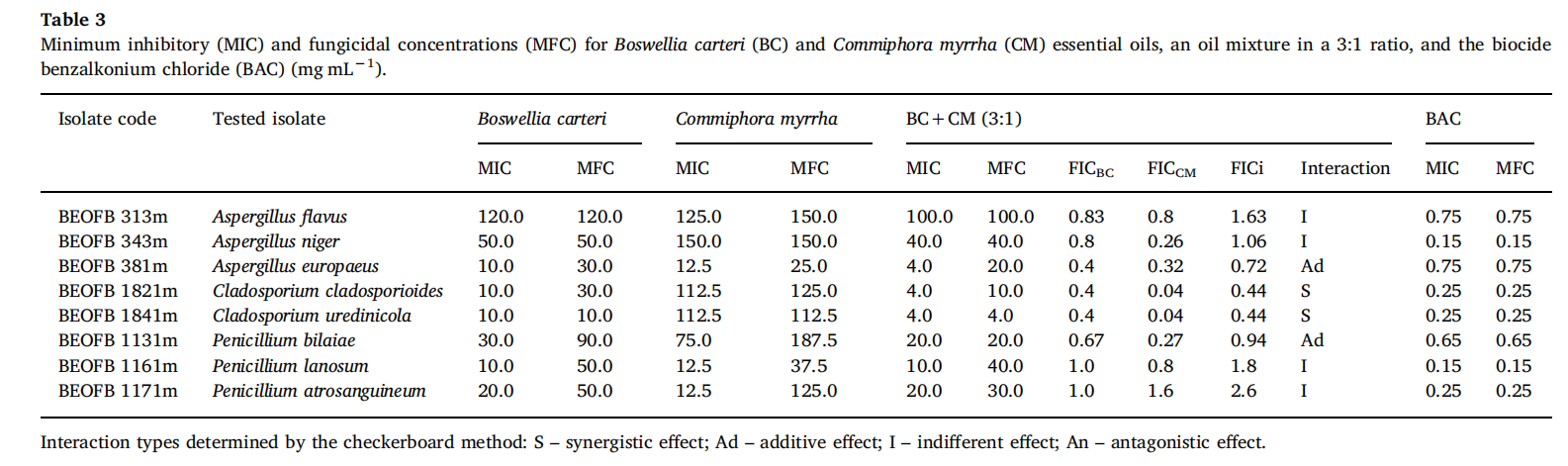
对所有受试菌株测定两种精油的MIC和MBC值。获得的MIC值在0.06至2 mg-mL范围内−1,没药精油中几乎所有的分离株都更敏感(表4)。乳香精油的最低MIC值记录为内部寄生冷杆菌(0.06 mg/mL),类棒菌状红球菌(0.25mg/mL),而其余菌株则更具耐药性。对分离株MK 1.3(>2.00 mg/mL)测定了乳香精油的最高MIC值。MBC值是MIC值的两倍以上,浓度高于2mg-mL−1.大多数分离株,尤其是微球菌属、芽孢杆菌属和芽孢八叠球菌属,在没药精油中表现出良好的敏感性,MIC值通常在0.06至0.19 mg/mL之间,这与受试抗生素的作用相当。MBC值是MIC值的两倍甚至更多倍,但与乳香精油中的 MBC值相比显著更低。在本试验中,内部寄生冷杆菌(MK 5.4)是对这两种精油最敏感的菌株,并且对氨苄青霉素(0.2mg/mL)非常耐药,而短小芽孢杆菌(MK 2.1)、解淀粉芽孢杆菌(MK 2.4)和辛德勒不动杆菌(MK 9.1)的分离株对这两种油最具耐药性。有趣的是,分离株MK 9.4(屎肠球菌)(0.06 mg/mL)对没药精油敏感,同时对氨苄青霉素和链霉素有中度耐药性。甲醇作为溶剂(对照)没有抗菌活性。所有受试菌株对抗生素均表现出良好的敏感性(浓度范围为0.003-0.40mg/mL),但少数对氨苄青霉素和链霉素表现出耐药性(表4)。利福平对所有菌株而言有着最低的MIC值(0.03–0.013 mg/mL)。
在两项独立的研究中,Mohamed等人(2014、2016年)证明了几种革兰氏阳性和革兰氏阴性菌对没药精油抗真菌实验的显著敏感性,MIC值在2-5µL/mL和100-1000 µL/mL之间。一份没药精油的商业样品进一步证实了其良好抗菌活性(Maree等人,2014年)。Saeed和Sabir(2004)表明,在从印度没药精油中分离的七种倍半萜类化合物中,莪术烯对多种革兰氏阳性和革兰氏阴性细菌表现出最有效和持久的抑制活性。这一点很重要,因为在我们的没药精油中,莪术烯是第二主要的化合物(12.97%)。
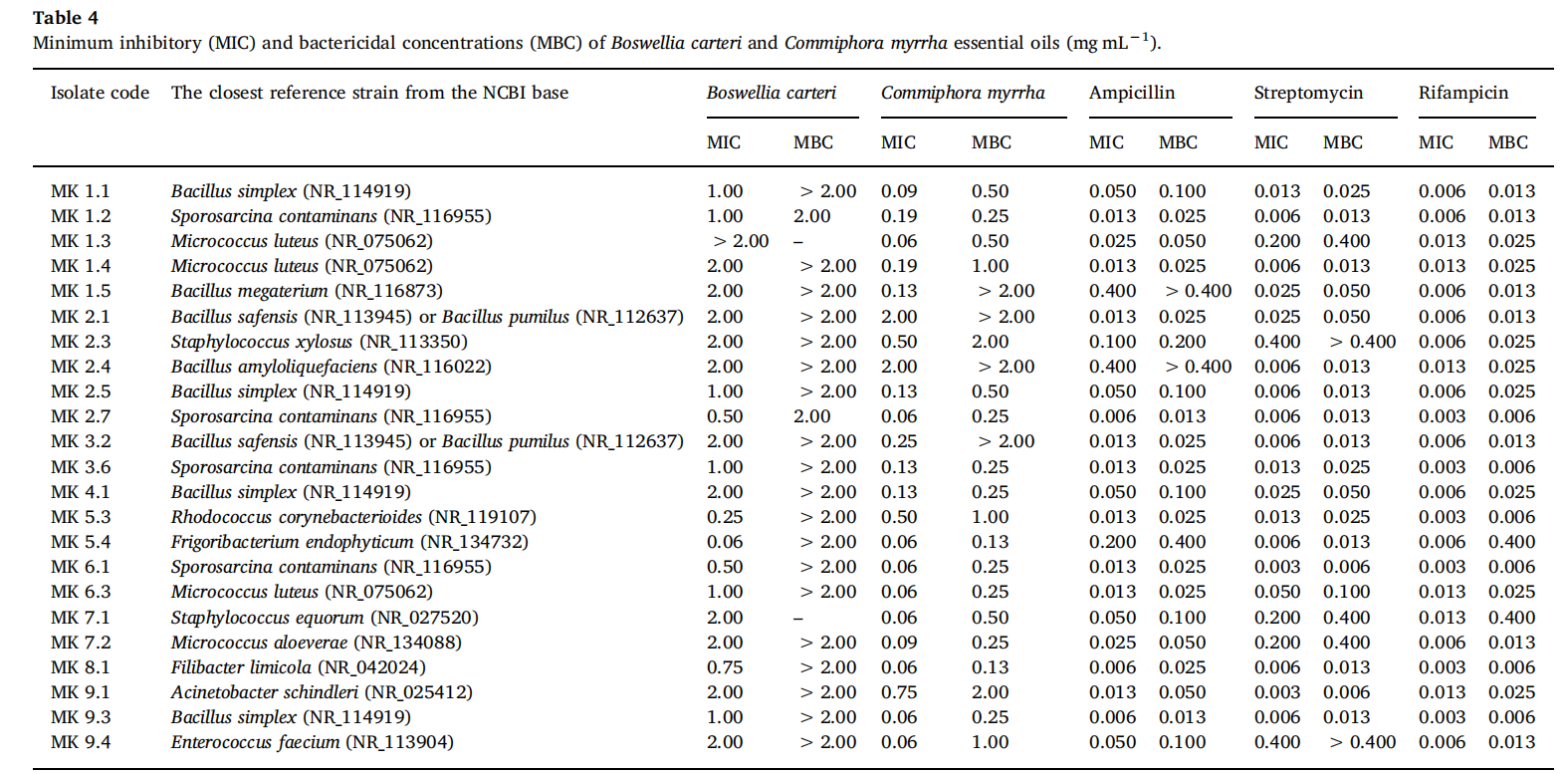
为了确定每种精油对抗菌活性的贡献,并确定它们之间的协同或拮抗作用,36种不同的精油浓度组合(1.0–0.031mg-mL−1)使用棋盘法(补充表1)进行调查。根据物种水平的差异或获得的MIC值,共选择了15个菌株。MIC结果转化为FIC和FIC指数,用于定义相互作用的性质和类型。对于所有受试菌株,两种精油在不同组合中的最低浓度如表5所示。测试的组合显示了所有类型的相互作用,并对五个菌株(MK 2.1、MK 2.4、MK 3.2、MK 5.3和MK 9.1)的协同作用进行了评分。有趣的是,分离株MK9.1是最具耐药性的菌株之一,其浓度比测定单个MIC值时记录的浓度低得多,显示出协同效应。与MK 2.1相反,MK 2.4和MK 3.2(属于腐生芽孢杆菌物种)抑制类棒状红球菌MK5.3和辛德勒不动杆菌MK 9.1被称为机会性人类病原体(Dortet al.,2006;Kitamura et al.,2012),这表明了所得结果的重要性。在大多数情况下,当乳香精油的浓度为0.031 mg/mL时,会产生协同作用;或在没药精油0.031-0.063mg/mL的浓度之间。三个分离株(MK 1.5、MK 8.1和MK 9.3中检测到相加作用,只有两个分离株(MK 5.4和MK 7.1)检测到拮抗作用,而在分离株MK 2.3、MK 7.2和MK 9.4中,在任何油浓度组合下均未记录到任何类型的相互作用。
本文给出的结果表明,与单一精油的作用相比,乳香精油和没药精油的组合被证明对真菌和细菌都更有效。自公元前1500年起,乳香精油和没药精油就被用于医疗目的,但在DeRapper等人(2012)的研究之前,没有进行任何研究来证实混合油有更强抗菌作用。尽管在任何组合中均未检测到乳香精油,但作者确实验证了各种乳香和没药物种获得的混合精油的增强抗菌效果。在所有测试的精油组合中,构树乳香和没药对致病性新型隐球菌和绿脓杆菌的总体相互作用最好。
3.8. 细菌对精油挥发相和熏香烟雾的敏感性
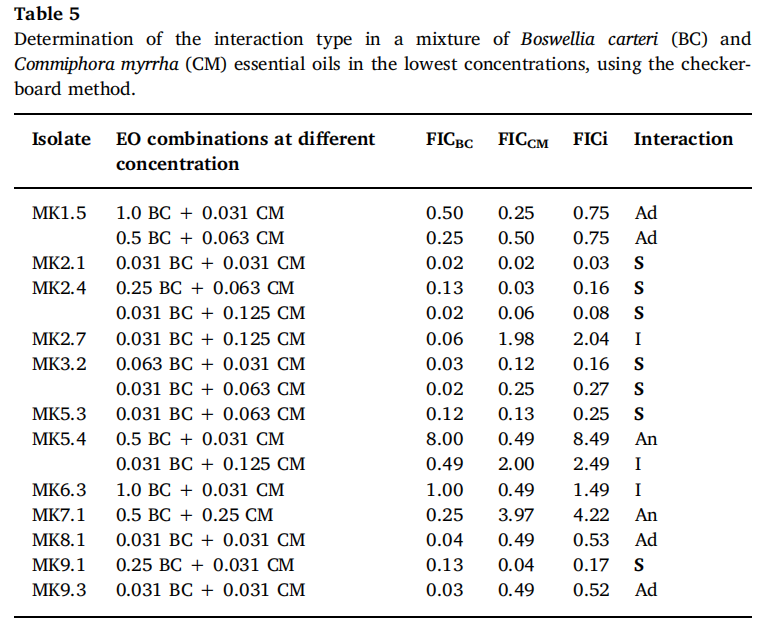
为了测试乳香精油挥发相和熏香烟雾的抗菌活性,对17个选定菌株进行了改良的微大气生物测定。与微量稀释法相反,精油液相的MIC值更高,乳香精油的气相和熏香的抗菌活性显著增强(表6)。与相应的对照组相比,精油和熏香烟雾对七种分离株(MK 1.1、MK 1.5、MK 2.7、MK 5.3、MK 6.1、MK 6.3和MK 9.3)的杀菌效果具有统计学意义的显著性。大多数分离物属于芽孢杆菌属和芽孢八叠球菌。在这种情况下,在所有测试稀释液中观察到完全没有细菌生长。总的来说,对所有分离株的最佳处理是在精油蒸汽12mg/cm3时完成。暴露在烟雾中表明,对于其余的分离株,在统计学上存在显著差异,但记录的CFU/ mL与对照组相比有所减少,在大多数情况下,指数符号较低。菌株MK 9.1(辛德勒曲霉菌)和MK 7.1(马葡萄球菌)的不敏感性被记录下来,这并不意外,因为在之前的试验中没有表现它们的协同作用。通过Chrom Biodip生物自动图谱测试评估,之前只有Basar(2005)证明了熏香烟雾对枯草芽孢杆菌具有良好的抗菌作用。除松柏烯衍生物和乙酸因香酯外,轮状聚伞花-4(20),7,11-三烯也认为具有抗菌作用。
3.9. 乳香精油和熏香烟雾的原位抗菌应用
进行的预处理空气微生物调查显示,中殿和圣器室都存在相当程度的微生物空气污染(图3)。由于在夏季的高峰期进行了现场试验,因此这些高值(中殿4798.94±512.42–6103.13±914.86 CFU/ m3,圣器室1455.17±37.69–2198.92±67.49CFU/ m3)符合季节性趋势。众所周知,在气候温和的地理区域,微生物繁殖体的最大浓度通常出现在相对湿度最高的夏季或秋季(Montacutelli等人,2000年)。目前,对于文化遗产场所空气中微生物繁殖体的最大允许浓度,没有普遍认可和接受的标准;然而,根据Cappitelli等人(2009);Nunes等人(2013年);Micheluz等人(2015年)给出的标准,Holy Ascension老教堂的中殿和圣器室中空气的微生物污染程度是最大允许浓度的几倍。
用乳香精油蒸汽处理圣器室中的空气半小时后,空气传播中的活真菌数量减少了45.39±2.83%(M40Y)和35.61±2.12%(MEA),而细菌数量减少了51.21±3.47%(MHA)和67.56±3.12%(MHA+N)(图3)。这些结果与体外记录的良好抗真菌和抗菌活性一致。在精油处理之前,仔细注意选择合适的应用方法、处理时间和精油浓度。考虑到精油在气相中的抗菌潜力,其他方法也存在问题,因此选择自然蒸发作为分散精油的方式。加热会增加蒸发率,精油的抗菌效果会受到影响,因为其某些成分可能会被改变或破坏(Su等人,2007年)。另一方面,由于酚类化合物在水中的溶解度很差,并且羟基化合物的挥发性降低,因此使用空气洗涤器不是分散精油蒸汽非常有效的方法,而香薰灯的使用并不方便,因为挥发物可以从高挥发性单萜烯类化合物转变为低挥发性单萜烯醇和倍半萜烯类化合物(Oberhofer等人,1999年;Sato等人,2006年)。根据公布的数据,决定让精油自然蒸发30分钟,这些数据表明,在蒸发开始后的这段时间内,大多数挥发性有机化合物的最高排放量才被记录为精油的抗菌活性(Su等人,2007)。最后,对于液相或气相的原位抗菌应用,需要比在体外获得MIC、MFC和MBC值时更高的精油浓度,因为在培养基中测试时,精油通常是更有效的抗菌剂,并且需要更高的浓度才能在原位产生相同的效果(Laird和Phillips,2011)。
在减少微生物空气污染方面,香熏处理比精油蒸汽处理更有效,活真菌数量减少78.95±1.87%(M40Y)和80.43±2.07%(MEA),细菌数量减少53.33±1.86%(MHA)和91.43±1.26%(MHA+N)(图3)。这些结果为最初的假设提供了一个新的实践维度,即空气净化是通过重要的传统烧香仪式实现的。
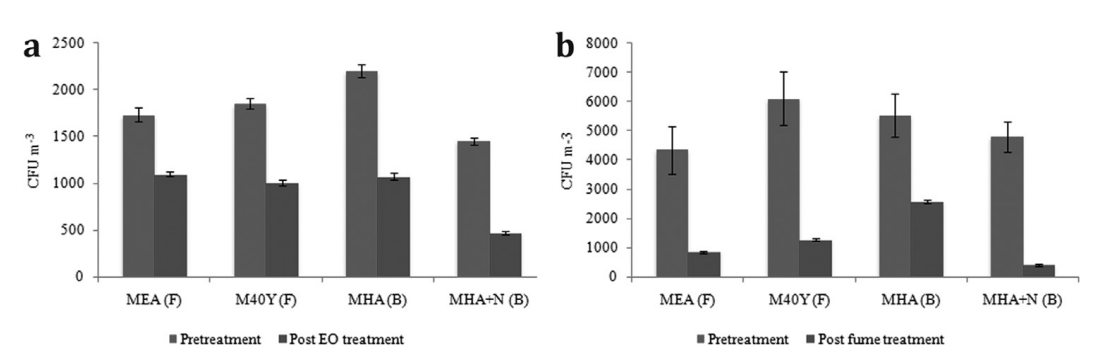
图3. 用a.乳香精油(EO)蒸汽;b.点燃熏香的烟雾处理空气中的活真菌(F)和活细菌(B)繁殖体的原位抗菌还原。
4.结论
从具有众所周知且有文献记载的传统用途的乳香树脂和没药树脂中得到的精油,其抗菌性能的研究表明,乳香精油和没药精油作为天然抗菌剂具有潜在的能力。尽管具有很高的抗菌潜力,但没药精油的产量太小,无法证明任何潜在的原位抗菌应用。相反,乳香精油的气相及其熏香在减少空气中真菌和细菌繁殖体的数量方面取得了显著的效果,从而表明它们可能被用作除日常仪式之外的神圣环境中偶尔进行空气净化的一种手段。
“牢记古人的智慧,在本文中,我们通过提供证据证明乳香精油和点燃其熏香的烟雾具有强大的抗菌活性,从而证明了熏香在宗教仪式之外的价值。这一证据表明,它们可能在神圣的氛围中用作净化空气。”--作者
翻译:蔡尉彤
编辑校对:Tao Feng