服务热线
177-5061-9273

细雨初晴花绽枝,玄参植下赶春时。
秋来收获染霜起,降压强心身健姿。
玄参属多年生草本植物,药材表面黄褐色,断面黑色,微有光泽。气特异似焦糖,味甘、微苦。在《本草纲目》中释名黑参、元参等。清-赵瑾叔在本草诗中阐明了玄参的功用:玄参黑润重乡邦,壮水无根火自降。年久疠疮消磊磊,时行目疾治双双。游风斑毒清多种,燥热狂烦去一腔。更有熏衣香可合,氤氲几阵透纱窗。说明玄参有凉血、降火、解毒的特异功效。

玄参
别名:元参、乌元参、黑参

采收加工:冬季茎叶枯萎时采挖。除去根茎、幼芽、须根及泥沙,晒或烘至半干,堆放3 ~6天,反复数次至干燥。发汗
基源植物:玄参科玄参属草本植物玄参的干燥根。
拉丁学名:Figwort Root
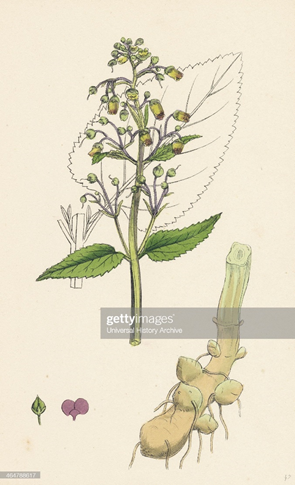
植物特征:
多年生草本,根圆柱形,下部常分叉,外皮灰黄褐色。茎直立,四枝形,光滑或有腺状柔毛。
叶对生;叶片卵形或卵状椭圆形,先端渐尖,基部圆形或近截形,边缘具钝锯齿,下面有稀疏散生的细毛。
聚伞花序疏散开展,呈圆锥状;花花序和花梗都有明显的腺毛;萼片5裂,卵圆形,先端钝,外面有腺状细毛;花冠暗紫色,管部斜壶状,有5裂片,上面2裂较长而大,侧面2裂片次之,下面裂片最小;雄蕊4,2强,另有1枚退化的雄蕊,呈鳞片状,贴生在花冠管上;花盘明显;子房上位,2室,花柱细长。花期7~8月。
蒴果卵圆形,先端短尖,深绿或暗绿色,长约8毫米,萼宿存。
果期8~9月。

玄参药材特征:
本品呈类圆柱形,中间略粗或上粗下细,有的微弯曲,表面灰黄色或灰褐色,有不规则的纵沟、横向皮孔及稀疏的横裂纹和须根痕。
质坚实,不易折断,断面黑色,微有光泽。气特异似焦糖,味甘、微苦咸。
以支条肥大、皮细、质坚、芦头修净、肉色乌黑者为佳。支条小、皮粗糙、带芦头者质次。

玄参药性:
炮制:除去残留根茎及杂质,洗净,润透,切薄片,干燥;或微泡,蒸透,稍晾,切薄片,干燥。
性味:甘、苦、咸,微寒。
归经:归肺、胃、肾经。
功能主治:凉血滋阴,泻火解毒。用于热病伤阴,舌绛烦渴,温毒发斑,津伤便秘,骨蒸劳嗽,目赤,咽痛,瘰疠,白喉,痈肿疮毒。
用法用量:9~15g。
注意:不宜与藜芦同用。
贮藏:置干燥处,防霉,防蛀。
1、玄参挥发油化学成分的GC-MS分析
目的:玄参是一种药用价值高、应用广泛的中药材。分析其挥发油成分,对扩大其利用,提高其附加值具有重要意义。方法:采用水蒸气蒸馏法对玄参挥发物进行分离,采用毛细管气相色谱/质谱法进行鉴定,面积归一化法测定玄参挥发物的相对含量。结果:共鉴定出64种挥发性成分,占峰面积的96.89%。结论:主要挥发性成分为:糠醛,5-甲基-2-呋喃甲醛,Z-5-甲基-6-二十一碳烯-ll-酮,棕榈酸,糠醇,酰基呋喃,松油醇,间甲酚,2-酰基吡咯,o-愈创木酚,苯乙醇,(2z)-2,4-戊二烯-1-醇,3-乙基异戊酸,螺环[2.4]庚-4-酮,苯乙醇,4-乙基-2-甲氧基-苯酚,4-乙烯基愈创木酚,丁酸。
2、玄参的药理学、植物化学和传统用途
在中国,玄参(Scrophularianingpoensis Hemsl)作为一种传统的药用植物已经被使用了几个世纪,用于治疗多种疾病,包括炎症、高血压、癌症和糖尿病。
本文综述了玄参的植物学、药理学、植物化学、药代动力学、传统用途和安全性等方面的最新研究进展,并指出玄参的未来研究需要和潜在用途。
所有关于玄参的信息均来源于科学数据库ScienceDirect、施普林格、PubMed、SciFinder、中国知网中国知识资源综合数据库、谷歌Scholar、百度Scholar等。其他信息从中草药书籍、博士论文和硕士论文中收集。植物分类学通过“植物名录”数据库(http://www.theplantlist.org)进行验证。
玄参在传统中医中具有退热、解毒、滋阴的功效。目前已从玄参中鉴定分离出162种化合物,包括环烯醚萜及环烯醚萜苷、苯丙苷、有机酸、挥发油、萜类、糖类、黄酮类、甾醇和皂苷。这些化合物具有多种药理特性,影响心血管、肝脏和神经系统,并保护身体免受炎症、氧化和癌变的影响。
现代药理学研究已证实玄参是一种珍贵的中草药,在治疗心血管、糖尿病、肝病等方面具有多种药理作用。玄参活性的主要来源是环烯醚萜苷和苯丙苷;然而,关于活性成分的分子机制、代谢活性、毒理学和结构-功能关系的详细信息还很有限。需要进一步的综合研究来评价玄参的药用特性。
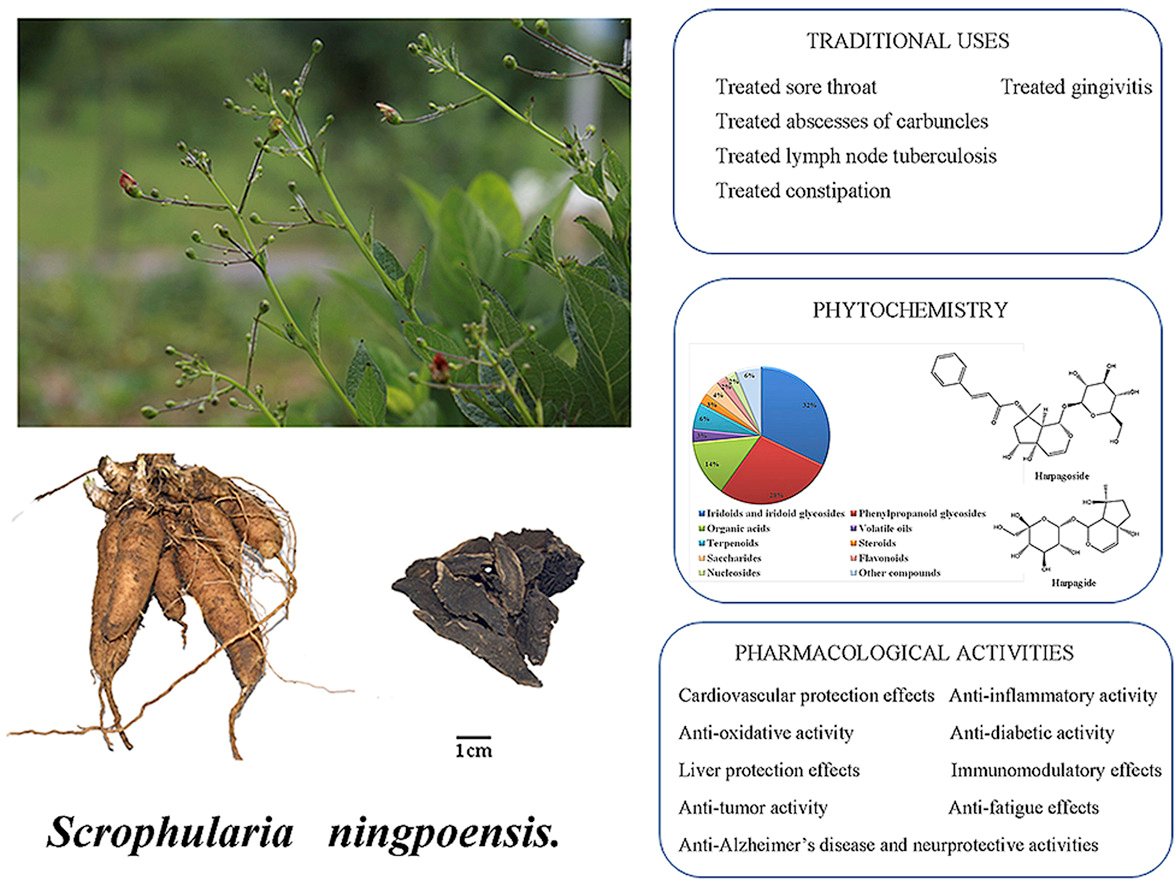
3、玄参的植物化学、药理、质量控制和药代动力学综述
玄参(Scrophularianingpoensis Hemsl)是东亚地区常用的药用植物。玄参(Scrophulariae Radix,SR)为SNH的干根,是SNH最常用的药用部位之一,是一种重要的传统药物,在东亚地区有2000多年的广泛使用历史。SR用于清热凉血,滋阴泻火,解毒化瘀。本文结合文献综述,对SNH的植物化学、药理、质量控制和药代动力学等方面进行系统综述。
目前已从SNH中分离鉴定出环烯醚萜类、酚苷类、酚酸类、生物碱类、黄酮类、三萜类等化合物。SNH的提取物和化学成分具有多重药理作用,如肝保护作用、抗炎作用、神经保护作用、抗心室重构作用等。目前已有多种方法来控制SNH的质量,主要是sr的质量控制。SNH中的一些生物活性化合物表现出不同的药代动力学行为和不同的代谢转化谱。
本文对其药理活性与传统用法的关系进行综述,对今后的合理使用和药物开发具有指导意义。
4、玄参属:环烯醚萜和萜类化合物的来源,具有多种生物活性
玄参属(玄参科)包括约350种,俗称玄参或元参。这个属的许多物种在自然界野生生长,尚未被栽培。然而,一些物种正处于灭绝的危险中。
本文综述了玄参属植物的化学成分、生物活性及民族药理学等方面的研究进展。所有信息均通过Scopus、美国国家农业图书馆、生物文摘、EMBASE、PubMed、MedlinePlus、PubChem和施普林格Link等文献数据库(1934-2017)报告数据获取。也收集了1957- 2007年各药典中关于该属的资料。本文报道了204个化合物的结构及其生物活性:其中,糖苷酯类、环烯醚萜类和三萜类化合物是该属中最常见的化合物。其中,如环烯醚萜等的脊髓灰质炎苷已显示出抗炎、保肝和伤口愈合的潜力。在较少被分离的化合物中,树脂糖苷如隐绿原酸(crypthophilic acids)显示了强大的抗原生动物和抗菌活性。
玄参属植物似乎是环烯醚萜类化合物的丰富来源,但其生物碱的分离和鉴定一直是科学研究中被忽视的领域。该属植物具有丰富的化学成分和生物活性,为进一步研究玄参属植物提供了新的治疗药物来源。
目前已对一些玄参属植物的精油进行了研究。伊朗西部和中部地区特有植物玄参耧斗菜(Scrophularia oxysepala)的精油中含有大量的丁香酚、脱氢丁香酚和甲基苯甲醇等酚类化合物。此外,据报道,伊朗特有植物抱茎玄参(Scrophulariaamplexicaulis Benth)精油中含有大量的丁香酚和乙酸丁香酚,对金黄色葡萄球菌具有抗菌活性。通过对玄参耧斗菜, 玄参抱茎草,斑纹玄参(S. striata)和玄参散沫草(S.frigida Boiss)的研究表明,1-辛烯-3-醇可能是玄参属的一种标记化合物。
玄参的抗炎活性
齿叶玄参(Scrophularia denata)“叶心巴”原产于塔巴田地区,是我国传统中草药。在NF-κB介导的报告基因荧光素酶检测中,从该植物中分离得到的环烯醚萜具有抗炎作用。环烯醚萜苷Scropolioside B和环烯醚萜苷ScropoliosideD对活化的B细胞核转录因子κ-轻链增强子(NF-κB)的活化有显著的抑制作用,IC50分别为43.7和1.02μM。Zhu等人(2015)研究了从齿叶玄参中分离的各种环烯醚萜苷scropoliosides对脂多糖(LPS)诱导的NF-κB活性、细胞因子mRNA表达、白细胞介素1β(IL-1β)分泌和环氧合酶-2活性的抗炎潜力。Scropoliosides B, F, G和6-O-甲基梓醇(6-O-methylcapitol)显著降低了THP-1细胞培养液中IL-1β的成熟和分泌。其他环萜烯醚苷A、B和D也抑制IL-1βmRNA的表达。环萜烯醚Scrodentosides A和B抑制环氧合酶2(COX-2)活性。在S. auriculata ssp. pseudoauriculata的研究中,结果表明,所分离的毛蕊花皂苷A和毛蕊花皂苷(verbasco saponin)对佛波醇-12-十四烷酰-13-乙酸酯(12-O-Tetradecanoylphorbol-13-acetate,TPA)(是一种具有潜在促癌作用的佛波酯,在生物医学研究中常用作蛋白激酶C(Protein kinase C,PKC)的激活剂)诱导的角叉菜胶足跖肿胀和耳肿胀均有抑制作用(TPA试验)。结果表明,与吲哚美辛(indomethacin)的0.35µmol/耳相比,毛蕊花皂苷A和毛蕊花皂苷的ID50分别为0.32和0.18μmol/耳,表明S.auriculata ssp. pseudoauriculata具有良好的抗炎作用。S. auriculata L.地上部分乙醇水提物和S.buergeriana根乙醇水提物分别对恶唑酮致小鼠耳肿胀(DTH)和炎症模型中组胺、肿瘤坏死因子-α (TNF-α)、IL-4的释放有显著抑制作用。在研究S. deserti的抗炎作用的过程中,对5种环烯醚萜苷进行了分离和鉴定,包括环烯醚萜苷D2、玄参苷(harpagoside)B、环烯醚萜苷D、koelzioside和8-氧-乙酰玄参苷。从S.deserti中分离得到的环烯醚萜苷Scropolioside D和玄参苷harpagosideB对角叉菜胶足肿胀具有明显的抗炎活性。Fernandez等报道了S.frutescens L.不同提取物的抗炎活性。在进一步的活性化合物筛选中,几种酚酸在TPA测试中具有显著的活性,在这些分离的酚酸化合物中,阿魏酸、龙胆酸(gentisic acid)、原儿茶酸(protocatechuicacid)和丁香酸(syringic acid)显著抑制水肿(原儿茶酸抑制71.59%;丁香抑制率为74.43%,阿魏酸抑制率为71.02%)。玄参是一种抗肿胀、抗喉炎、抗神经炎的中药,由多种环烯醚萜类化合物和苯醚类化合物组成,其亲水提取物对该动物模型有显著的抑制作用(ED50 20mg/kg)。在多个抗炎模型中,纹状玄参(Scrophularia striata)乙酸乙酯提取物均能抑制脂多糖(LPS)诱导的小鼠腹腔巨噬细胞IL-1β、TNF-α和前列腺素E2(PGE2)的分泌。
玄参的抑菌和抗原虫活性
伊朗特有植物抱茎玄参(Scrophulariaamplexicaulis Benth)精油挥发油对金黄色葡萄球菌具有良好的抑菌活性。该植物挥发油的特征是丁香酚(53.8%)和乙酸丁香酚(24.5%)含量高,这些化合物的抑菌活性已被证实。在另一项对抱茎玄参甲醇提取物及其组分的研究中,固相萃取水(SFE)中80%和60%(IC50为0.827,0.431 mg/mL)的甲醇相在血红素生物结晶试验中显示出显著的抗疟(antimalarial)活性。Tasdemir等研究了S.cryptophila中的色氨酸(tryptophan)和皂苷bulejasaponinIII等化合物的抗原虫和抗细菌活性,这些化合物对布氏锥体虫(Trypanosoma brucei)有生长抑制作用(IC504.1和9.7 mg/mL)。玄参苷(harpagide)和隐绿原酸C(crypthophilicacid C)对利什曼原虫(leishman)的IC50分别为2.0和5.8mg/mL。隐绿原酸C、色氨酸和皂苷bulujasaponin III对恶性疟原虫(Plasmodiumfalciparum)的IC50值分别为4.2、16.6和22.4mg/mL。对S. deserti乙醇提取物的研究表明,该植物提取物对布鲁氏杆菌(Brucellla melitensis)具有抗菌作用,在其他与该植物相关的研究中,分离出3(ζ)-羟基十八烷-4(E),6(Z)-二烯酸、筋骨草甙(ajugoside)和环烯醚萜苷B对耐多药和耐甲氧西林(methicillin)金黄色葡萄球菌(MRSA)和分枝杆菌(mycobacteria)具有较好的抗菌活性,其MIC值为32-128µg/mL。Fernandez等研究了S.frutescens和S. sambucifolia L.对蜡样芽孢杆菌(Bacilluscereus)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(S. aureus)、埃希氏大肠杆菌(Escherichiacoli)、黏质沙雷氏杆菌(Serratia marcescens)、沙门氏鼠伤寒杆菌(Salmonellatyphimurium)和腔隙莫拉氏菌(Moraxella lacunata)等微生物的抑菌活性组分。结果表明,两种植物的酚类组分对革兰氏阳性菌均有较强的抑菌活性,尤其是对芽孢杆菌属。玄参叶的70%乙醇提取物和皂苷(scrokoelziside)A对乙型溶血性链球菌(beta-haemolyticstreptococci)均具有抗菌活性。
玄参的肝脏保护和神经保护活性
分离自S.buergeriana的顺-对甲氧基肉桂酸(E-p-Methoxycinnamicacid)具有抗遗忘(anti-amnesic)活性,并对培养的神经元细胞抗谷氨酸诱导的神经毒性具有保护作用。未来寻找 S. buergeriana 在神经保护中的其他活性化合物的研究导致从该植物的根中分离出 10 种苯丙烷酯,尽管所有分离的苯丙烷酯都对谷氨酸诱导的神经变性发挥了显着的保护作用,但 buergeriside A1、buergerisideB1 和顺-对甲氧基肉桂酸表现出更好的保护作用。在其他神经保护化合物的连续分离中,8-O-E-p-甲氧基肉桂酰哈帕苷和哈帕苷、8-O-Z-对甲氧基肉桂酰哈帕苷、6'-O-E-p-甲氧基肉桂酰哈帕苷、6'-O-Z-p-甲氧基肉桂酰哈帕苷和Z-哈帕苷从这些植物中分离出来,并测试了谷氨酸诱导的大鼠神经毒性的降低。根据结果,这些化合物对培养的神经元表现出对谷氨酸诱导的氧化应激的保护作用。从 S. buergeriana 根中分离的苯丙烷在CCl4 诱导的毒性中表现出保肝作用。S. koelzii 地上部分的酒精提取物的氯仿部分表现出保肝活性。进一步的研究导致了几种环烯醚萜苷的分离,在这些化合物中,环烯醚萜苷A 在硫代乙酰胺肝毒性模型中显示出最大的肝保护活性。
结论
最近,对各种玄参的代谢物、药理活性和传统用途的研究显著增加。根据回顾的文献,有几个原因可能有助于筛选该属,其中包括(1)一些物种长期以来被用作传统或当地的治疗药物,特别是在亚洲和欧洲,以及这些物种的有效性和安全性物种已经确立。因此,这些来源引起了极大的兴趣和新的研究领域,以便更容易地搜索潜在的化合物。 (2)环烯醚萜甙、酚酸和三萜甙已被确定为玄参的三种主要化学成分。其中,像环烯醚萜结构的鼠尾草苷已显示出具有抗炎、保肝和伤口愈合活性作用的潜力。在不太经常分离的化合物中,树脂糖苷(如隐绿原酸)在抗原生动物和抗菌试验中显示出良好的特性。因此,该属的化合物将促进对玄参的进一步研究,并具有作为寻找新治疗药物来源的巨大潜力。 (3)大约350种玄参的相似物种大约只有 17 个进行了较为详细的研究。在从玄参中分离出来的代谢物中,只有少数被研究过它们的生物活性。许多关于分离或生物筛选的研究都是针对环烯醚萜苷和苯乙醇苷类化合物进行的,而研究人员较少考虑其他类别的植物化学物质,如生物碱、二萜和类黄酮。
一方面,大部分关于分离化合物的研究都是在体外/体内进行的,我们找不到任何关于玄参生物活性的临床试验。因此,这些代谢物在人体中的药代动力学和代谢尚不清楚。另一方面,活性分离分子的确切机制仍然未知。考虑到这些问题,目前的情况与最终目标之间存在巨大差距,即从分离的分子中开发批准的药物,甚至从玄参中开发膳食补充剂,活性提取物。对该属的分离的生物活性化合物进行 ADME(吸收、分布、代谢和排泄)研究似乎是必不可少的。
在大多数情况下,没有考虑对生物活性化合物进行定量分析,这可能会指导研究人员寻找其他生物活性化合物含量更高的玄参。尽管在不同药典中存在一些玄参物种及其在不同社会的传统或民间医学中的应用,但缺乏对这些物种的生物活性化合物的分析研究导致这些草药的质量控制和标准化困难。
一些代谢物,例如也表现出某些生物活性的环烯醚萜类化合物,在这些植物中很常见,可以将它们视为玄参属的生物标志物。
对该属中分离的生物活性化合物进行补充研究,例如对分离的生物活性化合物进行定量构效关系 (QSAR) 研究以及制备半合成衍生物,可能会产生更活跃的代谢物。
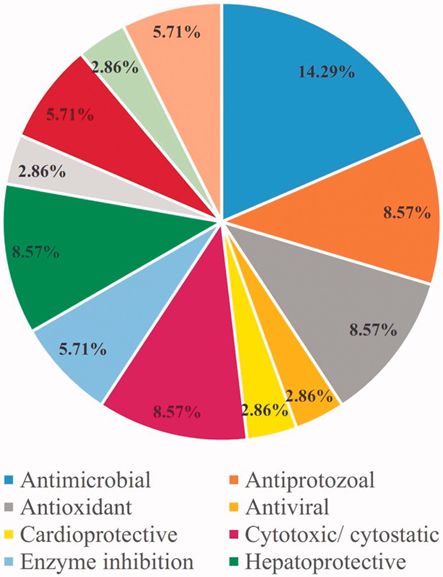
玄参药理活性相关报道的百分比例
5、玄参:其生物活性和保健品和药物应用概述
玄参(SR)作为一种药用植物具有重要作用,其根在亚洲被记录用于治疗发烧、肿胀、便秘、咽炎、喉炎、神经炎、喉咙痛、风湿病和关节炎两千多年.本文回顾了近20年来发表的关于玄参(SB)和宁波玄参(SN)的研究,并在体外和体内研究的基础上评价了SB和SN的生物学活性。SB具有抗炎活性、免疫增强作用、骨病预防活性、神经保护作用、抗遗忘作用和抗过敏作用; SN表现出神经保护作用、抗凋亡作用、抗遗忘作用和抗抑郁作用;通过体外和体内实验,SR 表现出免疫增强作用和心脏保护作用。已知SB 和 SN 都具有神经保护和抗失眠作用。本综述调查了它们在营养保健品、功能性食品和制药行业的适用性。需要对包括 SB 和SN 在内的 SR 的有效性和安全性进行进一步的研究,例如毒理学研究和临床试验。
参考文献:
[1]Z. Chi, C. Shao-Liang and L. Xing-Ping,"Analysis of chemical constituents of volatile oil of scrophularianingpoensis hemsl GC-MS," Proceedings of 2011 International Conference on Electronic &Mechanical Engineering and Information Technology, 2011, pp. 493-496, doi: 10.1109/EMEIT.2011.6022978.
[2] Dan Ren, Zhan-yun Shen, Lu-ping Qin, Bo Zhu,Pharmacology,phytochemistry, and traditional uses of Scrophularia ningpoensis Hemsl,Journalof Ethnopharmacology,2021, 269,
113688,doi.10.1016/j.jep.2020.113688.
[3] QingZhang, An Liu, Yuesheng Wang, Scrophularia ningpoensis Hemsl: a review of its phytochemistry, pharmacology,quality control and pharmacokinetics, Journal of Pharmacy and Pharmacology, Volume 73, Issue5, May 2021, Pages 573–600, https://doi.org/10.1093/jpp/rgaa036
[4]Pasdaran, Ardalan, and Azadeh Hamedi. “Thegenus Scrophularia: a source of iridoids and terpenoids with a diverse biologicalactivity.” Pharmaceutical biology vol. 55,1 (2017): 2211-2233.doi:10.1080/13880209.2017.1397178
[5] Lee, H. J., Kim, H. L., Lee, D. R., Choi,B. K., & Yang, S. H. (2021). Scrophulariae Radix: An Overview of ItsBiological Activities and Nutraceutical and Pharmaceutical Applications.Molecules (Basel, Switzerland), 26(17), 5250.https://doi.org/10.3390/molecules26175250