服务热线
177-5061-9273

《诗经•小雅•鹿鸣》云:“呦呦鹿鸣,食野之蒿。我有嘉宾,德音孔昭。视民不恌,君子是则是效。我有旨酒,嘉宾式燕以敖。”此蒿,青蒿也。青蒿作为中药已有2000多年的历史。目前, 青蒿素及其衍生物是世界上治疗疟疾最有效的药物, 青蒿素联合疗法已被用于几乎所有国家和地区的疟区, 每年治疗病例一亿以上, 降低了全球疟疾的发生率和死亡率, 挽救了数百万人的生命。

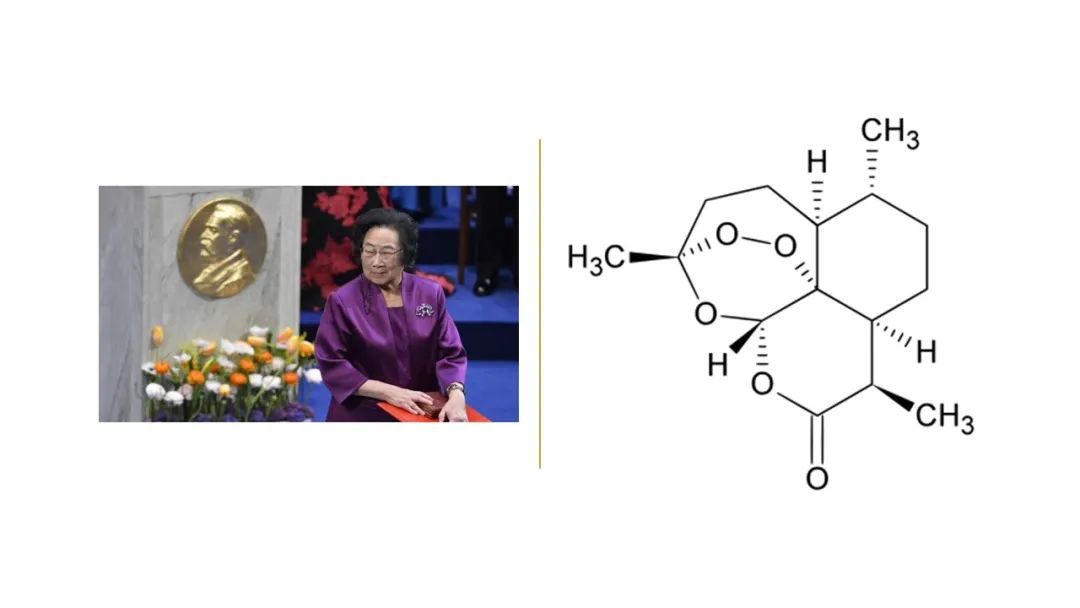
青蒿素来自中医药、发现启迪于中医药,它是中国传统医学和现代科技紧密结合,是中医药对人类健康事业作出的一项巨大贡献。2015年10月, 屠呦呦以“从中医药古典文献中获取灵感, 先驱性地发现青蒿素, 开创疟疾治疗新方法”, 获得世界影响力最大的自然科学奖项——诺贝尔生理学或医学奖。屠呦呦注定与青蒿有缘,其名字就来源于诗经中的“呦呦鹿鸣,食野之蒿”。
青蒿抗疟,源于古方
疟疾曾是我国主要的寄生虫病之一, 流行历史久远, 对健康危害甚大。我国在3000多年前就已有疟疾流行的记载,疟疾是先秦两汉时期主要的流行病之一。殷商时期, 甲骨文中所用“疟”字, 形似老虎张口扑向人。《礼记•月令第六》称: “民多虐疾”。北魏《水经注第三十六》称: 泸水(今金沙江部分流域)两岸“时有瘴气, 三月、四月径之必死”。“瘴气”是疟疾的另一古称。
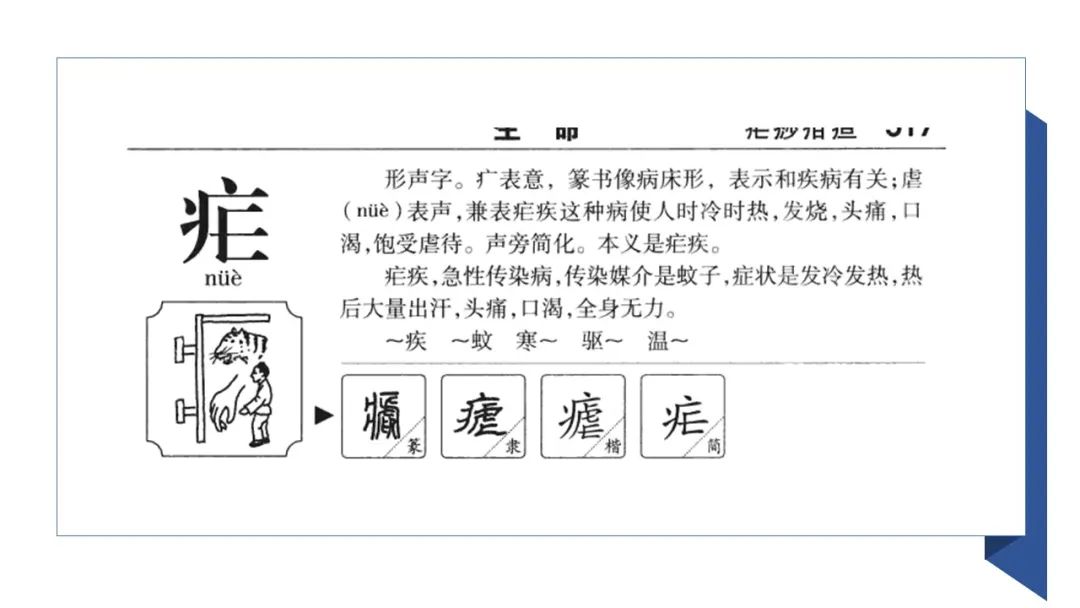
在古代, 疟疾对战时的士兵伤害很大,是影响军事活动最严重的疫病之一。蜀汉诸葛亮因瘴而推迟南征。唐玄宗派李宓率7万大军征伐南诏,因瘴疫等全军皆没。元朝大德和清乾隆年间向南方用兵,数度因疟疾而挫,有时竟“及至未战,士卒死者十已七八”。据报道, 美国南北战争中有131.6万人感染疟疾,其中约一万人死亡。第二次世界大战期间,美国在非洲和南太平洋的驻军中有6万人死于疟疾。

新中国成立前,疟疾在我国乡村和城镇都曾严重流行。据不完全统计, 20世纪40年代, 每年至少有3000万以上患者,病死率约为1%。20世纪50年代初期,全国有疟疾流行的县(市)计1829个,占当时县市总数的70%~80%。
疟疾是我国古代医籍中记载传染病最早最详的病种。《神农本草经》、《肘后备急方》、《千金要方》等记载了常山及其嫩枝叶(蜀漆)、青蒿和马鞭草等截疟功效。青蒿始载于马王堆出土文物帛书《五十二病方》“牝痔方”:“青蒿者,荆名曰萩,主疗痔疮”,距今已有两千余年。东汉《神农本草经》以“草蒿”为其正名,以“青蒿”为别名。
唐以前,青蒿入药主要用于治暑热、外治疥疮等。宋元明时期,青蒿进入了治疗急性热病的领域,也有了关于“治疟疾寒热”功效和使用的记载。清代以来,随着温病学的发展,青蒿为温热病学家普遍重视,并作为道地药材广泛应用。现存最早关于青蒿有截疟的文献是东晋《肘后备急方》的记载。其后,宋代《太平圣惠方》中有青蒿散,主要用于“妇人骨蒸劳热,四肢烦疼”; 《圣济总录》卷一六八中“青蒿汤”,主要用于小儿潮热; 元代《丹溪心法》卷二中的“截疟青蒿丸”,主要用来治疗疟疾; 明代《普济方》中有“青蒿散”、“祛疟神应丸”等的记载; 清《温病条辨》、《本草备要》也都有青蒿截疟的记载。宋元明清各医籍本草均以复方青蒿汤、截疟青蒿丸、青蒿散等治疟记载。

1888 年,法国军医 Charles Louis Alphonse Laveran在非洲疟疾患者血液的红细胞中发现疟原虫。1897年,英国医生Ronald Ross证实按蚊是疟原虫传播媒介(他们分别获1907和1902年诺贝尔奖)。

以前,南美洲秘鲁的土著人已用安第斯山区中的一类树皮抗病退烧,植物学家林奈将该树定名为“金鸡纳(chinchona)”。1820年,两位法国化学家从中分离获得抗疟成分奎宁(金鸡纳霜)。1934年,德国科学家Hans Andersag与同事在奎宁基础上合成氯喹,氯喹成为当时全球治疗疟疾的特效药物。

但从20世纪60年代初开始,疟原虫对氯喹类药物出现抗药性,从东南亚、南美到非洲波及全球,疟疾肆虐又失去控制,人们盼求新的抗疟药物。
20世纪70年代,屠呦呦团队研发的青蒿素成为了治疗疟疾的关键。屠呦呦在研究治疗疟疾的药物时,将焦点锁定在青蒿,是受东晋名医葛洪《肘后备急方》中“青蒿一握,以水二升,渍绞取汁,尽服之”可治“久疟”的启发,从植物青蒿里压出青蒿汁液,汁液里很可能有“抗疟”的化学成分。从现代植物学的角度考证,古书中的青蒿就是植物学意义上的黄花蒿。
在反复阅读东晋葛洪《肘后备急方》后,屠呦呦发现其中记述用青蒿抗疟是通过“绞汁”,而不是传统中药“水煎”的方法来用药的,屠呦呦认为很可能是因为“高温”的原因破坏了其中的有效成分。据此,屠呦呦改用低沸点的溶剂乙醚来提取青蒿中的有效成分,结果显示青蒿提取物能大幅杀灭疟原虫,疗效优于氯喹。1972年成功分离出一种无色结晶,后将其命名为青蒿素。

青蒿(学名:Artemisia carvifolia)是菊科蒿属的一种植物。按中国药典,中医中的“青蒿”指的是黄花蒿的地上部分,而不是青蒿。虽然青蒿在中文中与青蒿素名称类似,但是青蒿素并不是从青蒿中提取,而是来自同为蒿属(Artemisia) 的黄花蒿(Artemisia annua)。

别名 蒿子、臭蒿、香蒿、苦蒿、臭青蒿、香青蒿、细叶蒿、细青蒿、草青蒿、草蒿子、蒿、荍、草蒿、方渍、三庚草、野兰蒿、黑蒿、白染艮、方溃、香丝草、酒饼草
功效作用 清热;解暑;除蒸;截疟。主暑热;暑湿;湿温;阴虚发热;疟疾;黄疸
英文名 Sweet Wormwood Herb,Herb of Sweet Wormwood
始载于 《神农本草经》
毒性 无毒
归经 胆经、肝经
药性 寒
药味 辛、苦
为菊科植物青蒿Artemisia annua L.的干燥地上部分。清热解暑,除蒸,截疟。用于暑邪发热,阴虚发热,夜热早凉,骨蒸劳热,疟疾寒热,湿热黄疸。是一种廉价的抗疟疾药。青蒿的道地产区应在历史上的荆州(今湖北) 及其周边地区,从抗疟成分青蒿素含量高低的角度,青蒿道地产区应在重庆、广西及周边省份。黄花蒿在秋季花盛开时采收,抗疟用青蒿素含量较高,黄花蒿放置半年后青蒿素可降解 30%左右,一般需放置阴凉干燥处贮藏。
植物学上的青蒿
植物学上的青蒿是Artemisia carvifolia ,此种药用清热解暑,可提取化妆品香精,不具抗疟作用。

形态特征
一年生草本;植株有香气。一些地方也叫牛尿蒿。主根单一,垂直,侧根少。茎单生,高30—150厘米,上部多分枝,幼时绿色,有纵纹,下部稍木质化,纤细,无毛。叶两面青绿色或淡绿色,无毛;基生叶与茎下部叶三回栉齿状羽状分裂,有长叶柄,花期叶凋谢;中部叶长圆形、长圆状卵形或椭圆形,长5-15厘米,宽2-5.5厘米,二回栉齿状羽状分裂,第一回全裂,每侧有裂片4-6枚,裂片长圆形,基部楔形,每裂片具多枚长三角形的栉齿或为细小、略呈线状披针形的小裂片,先端锐尖,两侧常有1—3枚小裂齿或无裂齿,中轴与裂片羽轴常有小锯齿,叶柄长0.5-1厘米,基部有小形半抱茎的假托叶;上部叶与苞片叶一(至二)回栉齿状羽状分裂,无柄。头状花序半球形或近半球形,直径3.5-4毫米,具短梗,下垂,基部有线形的小苞叶,在分枝上排成穗状花序式的总状花序,并在茎上组成中等开展的圆锥花序;总苞片3-4层,外层总苞片狭小,长卵形或卵状披针形,背面绿色,无毛,有细小白点,边缘宽膜质,中层总苞片稍大,宽卵形或长卵形,边宽膜质,内层总苞片半膜质或膜质,顶端圆;花序托球形;花淡黄色;雌花10-20朵,花冠狭管状,檐部具2裂齿,花柱伸出花冠管外,先端2叉,叉端尖;两性花30—40朵,孕育或中间若干朵不孕育,花冠管状,花药线形,上端附属物尖,长三角形,基部圆钝,花柱与花冠等长或略长于花冠,顶端2叉,叉端截形,有睫毛。瘦果长圆形至椭圆形。花果期6-9月。
地理分布
产吉林、辽宁、河北(南部)、陕西(南部)、山东、江苏、安徽、浙江、江西、福建、河南、湖北、湖南、广东、广西、四川(东部)、贵州、云南等省区;常星散生于低海拔、湿润的河岸边砂地、山谷、林缘、路旁等,也见于滨海地区。
朝鲜、日本、越南(北部)、缅甸、印度(北部)及尼泊尔等也有。模式标本采自喜马拉雅山脉东南部地区。
能提取青蒿素的青蒿
能够提取所谓“青蒿素”的所谓“青蒿”,是植物学的上的黄花蒿Artemisia annua ,该种有特异的甜香气,味苦不可食。

形态特征
为一年生草本,高达1.5m,全株黄绿色,有浓烈的挥发性香气。茎直立呈圆柱形,多分枝,表面黄绿色或棕黄色,具纵棱线,质略硬,易折断,断面中部有髓;叶互生,暗绿色或棕绿色,卷缩易碎,完整者展平后为三回羽状深裂,裂片及小裂片矩圆形或长椭圆形,两顼被短毛。气香特异,味微苦;茎基部及下部的叶在花期枯萎,中部叶卵形,二至三回羽状深裂,上面绿色,下面色较浅,两面被短微毛;上部叶小,常一次羽状细裂。头状花序极多数,球形,直径1.5~2mm,有短梗,下垂,总苞球形,苞片2~3层,无毛,小花均为管状,黄色,边缘雌性,中央两性,均能结实。瘦果椭圆形,长约0.7mm,无毛。花期7~10月,果期9~11月。
地理分布
全国各地。
青蒿的主要化学成分
青蒿的化学成分可分为挥发性成分和非挥发性成分。挥发性成分主要为挥发油,含量约为 0.2~0.25%,其中以莰烯、β-莰烯、异蒿酮、左旋樟脑、β-丁香烯和 β-蒎烯为主,约占挥发油总量的 70%。此外还含有蒿酮、1,8-桉精油、樟脑、枯茗醛等成分。非挥发性成分主要包括倍半萜类、黄酮类以及香豆素类,另外还含有蛋白质(如β-半乳糖苷酶、β-葡萄糖苷酶)和类固醇类(如β-谷甾醇、豆甾醇)。青蒿的主要化学成分是倍半萜类,包括青蒿素、青蒿甲素、青蒿乙素、青蒿丙素、青蒿丁素、青蒿戊素、青蒿酸、青蒿内酯、青蒿醇和环氧青蒿酸。
青蒿素的理化性质
青蒿素(英语:artemisinin;也称黄花蒿素)及其衍生物是现今所有药物中起效最快的抗恶性疟原虫疟疾药。使用包含青蒿素衍生物在内的青蒿素联合疗法是现今全球范围内治疗恶性疟原虫疟疾的标准方法。青蒿素提取自黄花蒿,1969-1972年间,中国科学家屠呦呦参与的523课题组发现并从黄花蒿中提取了青蒿素,屠呦呦也因此获得2011年拉斯克临床医学奖和2015年诺贝尔医学奖。
化学上,青蒿素是少见的一种含有过氧桥的倍半萜内酯类化合物。普遍认为这种过氧化结构与青蒿素的抗疟活性有关。已知其他多种天然来源的含有过氧桥的化合物。
世界卫生组织明确指出不要单独使用青蒿素进行治疗,因为有研究指出这会增加疟原虫的耐药性。已证明使用包括青蒿素在内的多药联合疗法治疗疟疾同时具有很好的效果和耐受性。使用青蒿素来治疗间日疟原虫疟疾也越来越普遍,并且使用其来治疗癌症也是近来研究的课题之一。
物理性质
青蒿素在常温下是一种无色针状晶体,密度1.3g/cm3,比旋光度+68°(C=1.6,溶剂氯仿),几乎不溶于水,易溶于氯仿、乙酸乙酯和苯;常压下熔点156℃-157℃。青蒿素属于正交晶系,空间群D2-P212121,晶胞参数a = 24Å b= 9.4Å c= 6.3Å。其红外光谱具有δ-内酯羰基的吸收(1745cm-1)和过氧键的吸收(831、881、1115cm-1);其质谱具有质荷比为250的峰,对应的物种为分子脱去过氧桥后形成的分子离子。
化学性质
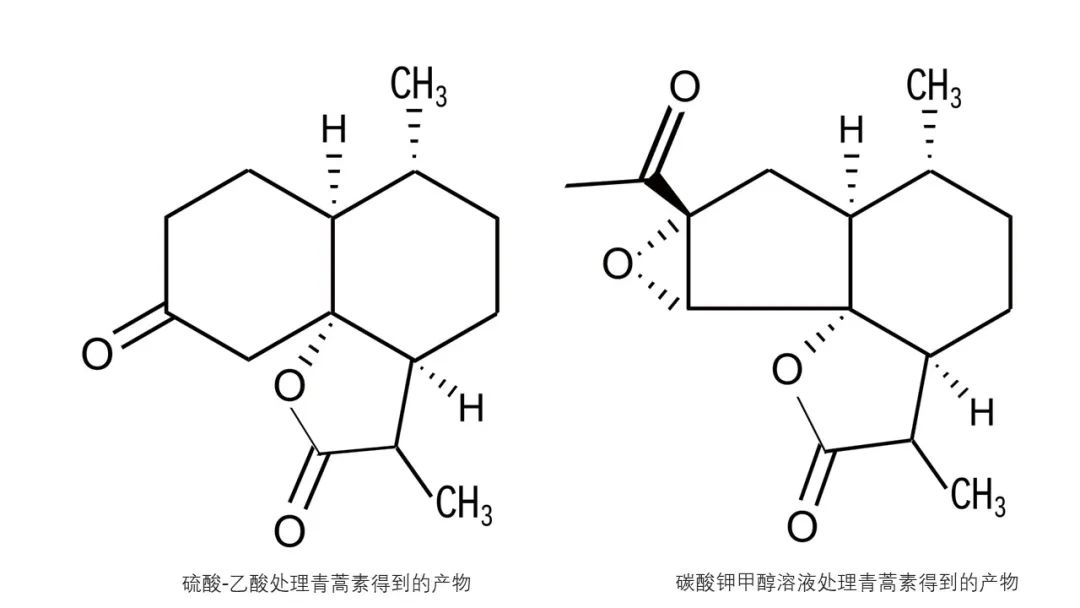
青蒿素是一种内酯,因而可以与盐酸羟胺发生反应,产物遇铁离子显色。虽然青蒿素含有过氧键,但相较于其他的过氧化物,青蒿素化学性质较为稳定,加热到熔点仍不分解。青蒿素可被三苯膦或碘离子定量地还原,这一反应可用于定量分析。在常压和钯-碳酸钙催化下,青蒿素的过氧键可被氢气还原,生成氢化青蒿素(C15H22O4)。以硼氢化钠处理青蒿素,则内酯的羰基被还原,生成半缩醛还原青蒿素(C15H24O5)。
室温下以碳酸钾甲醇溶液处理青蒿素一小时,酸化后可以得到一种含有环氧基团的五元环内酯(C15H20O4);以硫酸-乙酸处理青蒿素可以得到另一种五元环内酯(C14H20O3)。
青蒿素在黄花蒿中的生物合成
黄花蒿分布地域狭窄,青蒿素含量偏低(0.01%~0.5%),中国以外地区野生黄花蒿因青蒿素含量太低而没有商业开发价值。
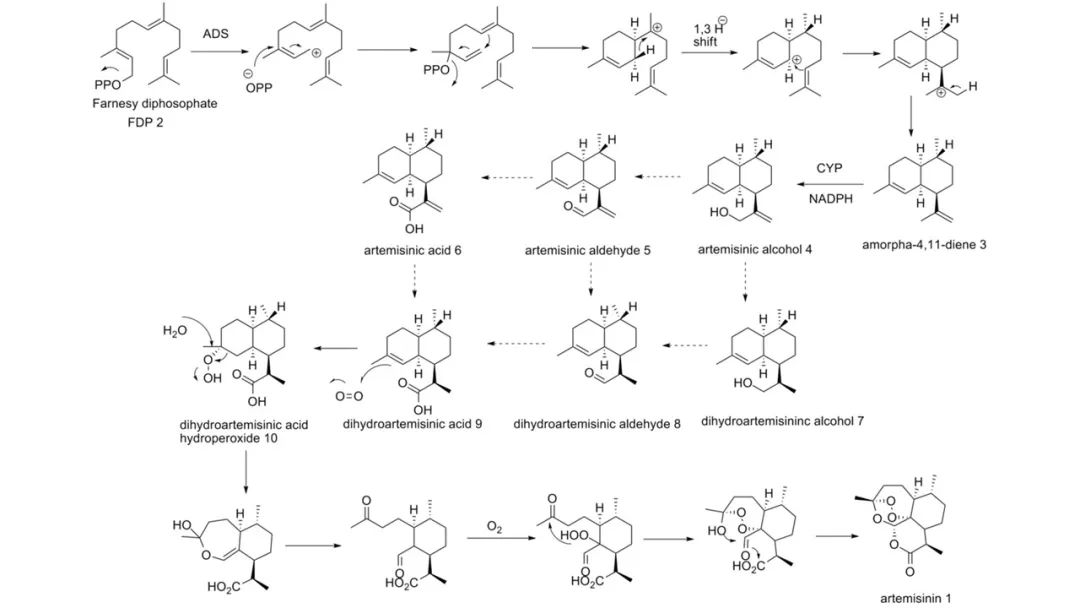
全合成
1982年,罗氏公司的研究员G.Schmid和W.Hofheinz以薄荷醇为原料首次完成了青蒿素全合成。稍后,上海有机所的周维善等人以香草醛为原料完成了这一全合成。至2003年已有十余种青蒿素全合成路线。这些路线的起始物包括薄荷酮、3-蒈烯和环己烯酮。
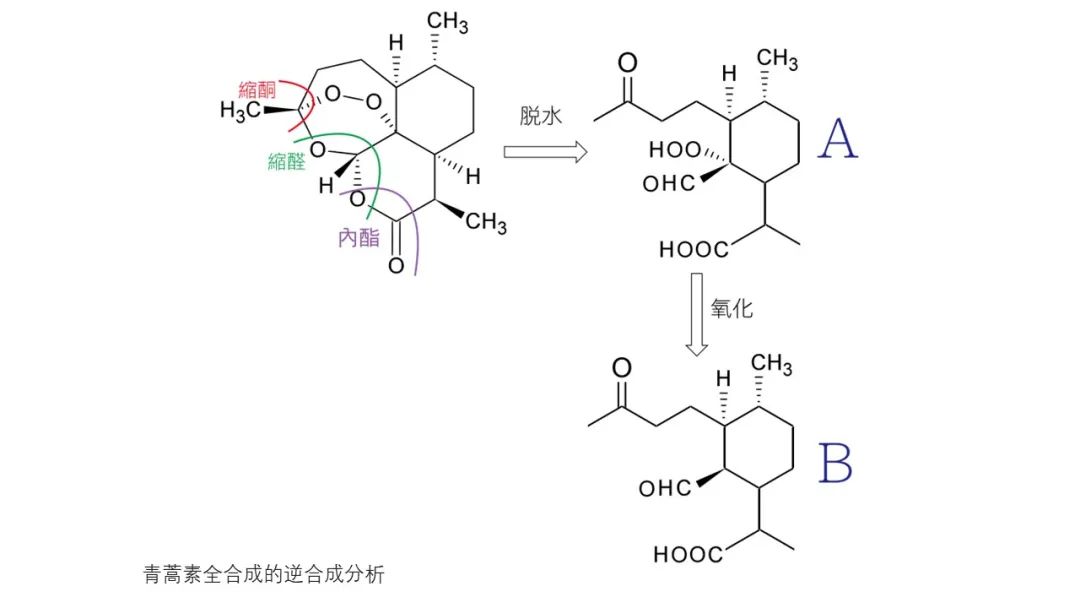
从逆合成分析的角度看,青蒿素的一个特点是它的结构中含有一个1,2,4-三𫫇唑环。该环实际上是一个缩酮-缩醛-内酯体系的一部分,可以由上图中α-过氧羟基醛(A)经缩合反应构建。过氧羟基醛(A)又可以由醛(B)的烯醇醚或类似化合物经过氧化反应获得。过氧化是青蒿素合成中的关键步骤,尽管不同的路线采用不同的方法引入过氧基团,这步反应产率总是比较低。
Schmid等人、Ravindranathan等人、Lansbury等人、周维善等人利用烯醇醚在低温、光照和光敏剂存在下与单线态的氧分子发生的[2+2]环加成反应产生四员环中间体,然后开环形成过氧化物;Avery等人则利用烯基硅烷的反常臭氧化反应引入过氧基团。用酸处理过氧化产物就可以得到青蒿素。
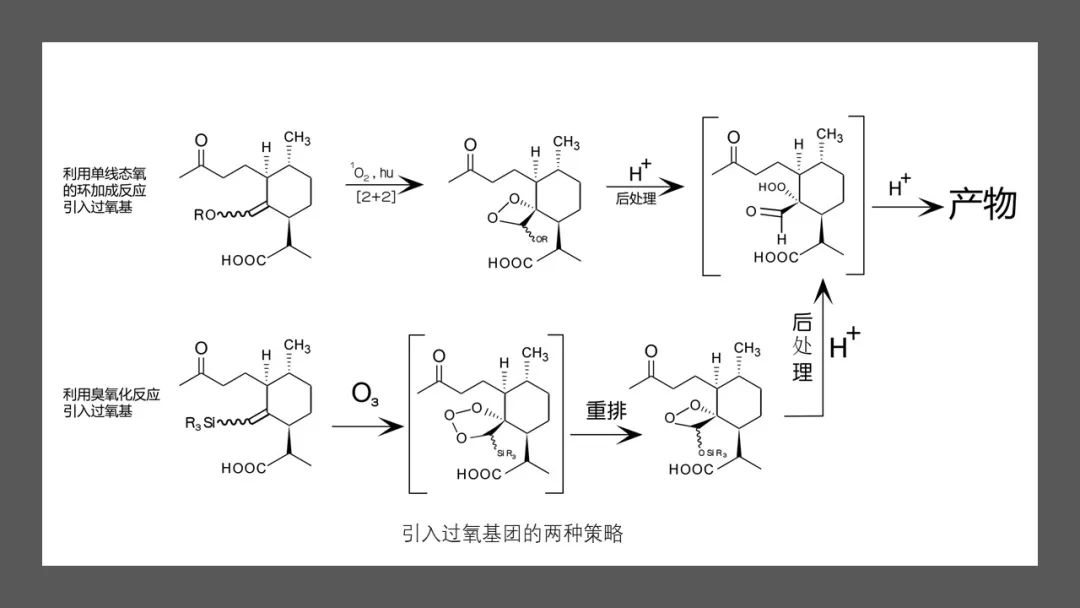
1989年,Nancy Acton等人发现,在低温和光照下,二氢青蒿酸可以被两当量的氧气直接氧化成青蒿素,产率17%-32%。后续研究表明在反应中,二氢青蒿酸先与一分子单线态氧发生烯反应,生成过氧化物。再与另一分子三线态氧反应,开环生成α-过氧羟基醛(A),最后脱水产生青蒿素。不久这一反应就被用于改进青蒿素的全合成路线。化学合成青蒿素工艺繁杂,步骤多,成本高,易污染,尤其引入过氧基团的光氧化或化学氧化的产率不理想,导致化学全合成工艺一直无法用于青蒿素的商业化生产。
微生物工程菌全合成青蒿酸
黄花蒿与酵母合成萜类前体法呢基焦磷酸的酶促反应完全相同,只要在酵母中增加一个代谢支路就能让酵母菌合成青蒿素。2006年,美国加州大学的Keasling小组将ADS 基因连同新克隆的细胞色素P450 单氧化酶基因(CYP71AV1)及其还原酶基因(CPR)同时导入酿酒酵母中表达,培育出世界上第一株生产青蒿酸的酵母工程菌。加拿大植物生物技术研究所的Covello小组于2008 年从黄花蒿中分离到双键还原酶基因(DBR2),并将该基因连同ADS、CYP71AV1、CPR 基因一起导入酿酒酵母,率先培育出能合成双氢青蒿酸的酵母工程菌。
酵母工程菌中未检测到青蒿素的原因可能有两个:一是酿酒酵母中单线态氧缺乏,双氢青蒿酸合成后不能转变成青蒿素;二是青蒿素未被油相环境隔离而与细胞成分(如血红素)发生烷基化反应,无法检测到青蒿素。黄花蒿是如何避免青蒿素对本身的伤害呢? Covello小组的研究显示,青蒿素合成酶基因在黄花蒿叶片表面具有特殊腺体结构并充满挥发油的腺状毛囊细胞中高效表达,说明具有毒性的青蒿素隔离在油相腺毛中应该是一种进化的选择。黄花蒿采取细胞分区和分相隔离的方式,合成并贮存具有细胞毒性的青蒿素,可用来杀灭猎食性害虫;同时青蒿素前体在油相环境中更易发生化学催化反应。据测定,青蒿植株中的青蒿素含量比双氢青蒿酸含量低5-10倍,最大可相差15倍。
2013年4月25日出版的Nature杂志发表了美国Keasling小组和加拿大Covello小组的两国科学家撰写的研究通信《强效抗疟剂青蒿素的高水平半合成生产》一文,报道了将酵母工程菌中青蒿素前体青蒿酸的发酵产量从1.6克/升提高到25克/升,并利用单线态氧成功地将青蒿酸转化成青蒿素。
青蒿素的药用价值
1.抗疟作用:青蒿乙醚提取中性部分和其稀醇浸膏对鼠疟、猴疟和人疟均呈显著抗疟作用。体内试验表明,青蒿素对疟原虫红细胞内期有杀灭作用,而对红细胞外期和红细胞前期无效。青蒿素具有快速抑制原虫成熟的作用。蒿甲醚乳剂的抗疟效果优于还原青蒿素琥珀酸钠水剂,是治疗凶险型疟疾的理想剂型。青蒿琥酯2.5、5、10、15mg/kg,2次/天,连续3天,皮肤外搽,治疗猴疟均有不同程度疗效。5、10mg/kg,2次/天,连续10天,皮肤外搽即可使猴疟转阴。加入适量促透氮酮,可提高抗疟作用。脱羰青蒿素和碳杂脱羰青蒿素对小鼠体内的伯氏疟原虫K173株的ED50和ED90分别为12.6mg/kg和25.8mg/kg。体外试验表明,青蒿素可明显抑制恶性疟原虫无性体的生长,有直接杀伤作用。青蒿素、蒿甲醚和氯喹对恶性疟原虫的IC50分别为75.2,29.4和43.2nmol/L。青蒿素酯钠对恶性疟原虫6个分离株(包括抗氯喹株)有抑制作用。
2.抗菌作用:青蒿水煎液对表皮葡萄球菌、卡他球菌、炭疽杆菌、白喉杆菌有较强的抑菌作用,对金黄色葡萄球菌、绿脓杆菌、痢疾杆菌、结核秆菌等也有一定的抑制作用。青蒿挥发油在0.25%浓度时,对所有皮肤癣菌有抑菌作用,在1%浓度时,对所有皮肤癣菌有杀菌作用。青蒿素有抗流感病毒的作用。青蒿酯钠对金葡萄、福氏痢疾杆菌、大肠杆菌、卡他球菌,甲型和乙型副伤寒秆菌均有一定的抗菌作用。青蒿中的谷甾醇和豆甾醇亦有抗病毒作用。
3.抗寄生虫作用:青蒿乙醚提取物、稀醇浸膏及青蒿素对鼠疟、猴疟、人疟均呈显著抗疟作用。体外培养提示,青蒿素对疟原虫有直接杀灭作用。电镜观察证明,青蒿素主要作用于疟原虫红细胞内期无性体的膜相结构,首先作用于食物色膜、表膜和线粒体膜,其次是核膜和内质网。此外对核内染色体亦有影响。由于食物泡膜发生变化,阻断了疟原虫摄取营养的早期阶段,使疟原虫迅速发生氨基酸饥饿,形成自噬泡,并不断排出体外,使泡浆大量损失,内部结构瓦解而死亡。青蒿素对间日疟、恶性疟及抗氯喹地区恶性疟均有疗效高、退热及原虫转阴时间快的特点,尤其适于抢救凶险性疟疾,但复燃率高。此外,青蒿尚有抗血吸虫及钩端螺旋体作用。
4.解热作用:用蒸馏法制备的青蒿注射液,对百、白、破三联疫苗致热的家兔有明显的解热作用。青蒿与金银花组方,利用蒸馏法制备的青银注射液,对伤寒、副伤寒甲、乙三联菌苗致热的家兔,有比单味青蒿注射液更为显著的退热效果,其降温特点迅速而持久,优于柴胡和安痛定注射液对照组。金银花与青蒿有协同解热作用。
5.免疫作用:用小鼠足垫试验、淋巴细胞转化试验、兔疫特异玫瑰花试验和溶血空斑试验等4项免疫指标观察青蒿素的免疫作用,发现青蒿素对体液免疫有明显的抑制作用,对细胞免疫有促进作用,可能具有免疫调节作。青蒿素、蒿甲醚有促进脾TS细胞增殖功能。肌肉注射蒿甲醚对Begle大外周血T、B、Tu及Tr淋巴细胞亦有明显抑制作用。亦明显降低正常小鼠血清IgG含量、增加脾脏重量。降低鸡红细胞致敏小鼠血清IgG含量。静脉注射青蒿素50-100mg/kg能显著提高小鼠腹腔巨噬细胞吞噬率(50.2-53.1%)和吞噬指数(1.58-1.91)。青蒿素还可提高淋巴细胞转化率,促进细胞免疫作用。青蒿琥酯可促进Ts细胞增殖,抑制TE细胞产生,阻止白细胞介素及各种炎症介质的释放,从而起到免疫调节作用。
6.对心血管系统的作用:兔心灌注表明,青蒿素可减慢心率,抑制心肌收缩力,降低冠脉流量。静脉注射有降血压作用,但不影响去甲肾上腺素的升压反应,认为主要系对心脏的直接抑制所改。静脉注射20mg/kg青蒿素可抗乌头碱所致兔心律失常。
7.其它作用:青蒿琥酯能显著缩短小鼠戊巴比妥睡眼时间。青蒿素对实验性矽肺有明显疗效。蒿甲醚对小鼠有辐射防护作用。
青蒿素发现的科学启示
青蒿素发现与屠呦呦获得诺贝尔奖确实令人振奋,但回顾青蒿素发现的过程,可以发现,青蒿素在发现初期并未进入科研人员的视野里,而且在其发掘过程中,也充满了许多挫折,其成功获得也有着一定的偶然,最初并非人为挑选出来的。1967年起,“523办公室”就开始组织全国7大省市、几十个单位共同攻关,筛选化合物、中草药4万多种未取得满意结果。其他有关国家也对此进行了大量研究工作。美国自20世纪60年代起,应战争急需而筛选的化合物达30万种,同样没有取得突破性进展。在从中医和西医角度搜集的各种方法均告失败时,1969年1月21日,中国中医研究院屠呦呦作为科研组长,正式参加“523”项目。她早期收集到的方剂包括植物、动物、矿物等2000余方药,并在此基础上整理出以640余个方药为主的《抗疟单验方集》。不过,在第一轮的药物筛选和实验中,青蒿提取物对疟疾的抑制率只有68%,还不及胡椒有效果。因此,当时他们的研究重点是黄丹等矿物药及其配伍的工作,在相当长的一段时间里,中草药植物青蒿并没有引起人们重视。青蒿素在发掘初期,不仅没有被寄予厚望,当时的研究人员甚至一度想放弃它。
许多项目虽然投入很大但很有可能最终结果并不理想,这些科研风险往往几十年之后才能发现。而且,科学研究有较大的不确定性,研究结果也许会发生极大的偏差,与预期目的也许并不吻合。这些风险往往是不可预计的,不能仅凭热情就去做类似的研究,并指望取得预期效果。
首先,值得注意的是,古籍文献记载中的青蒿与日后屠呦呦发现的青蒿素没有直接联系,古代文献中所指的青蒿与青蒿素根本不是一回事,治疗疟疾的有效成分青蒿素仅存在于黄花蒿中,不同品种青蒿素含量也不同。
屠呦呦在提取青蒿素过程中,早期采用的是北京植物青蒿。北京青蒿叶中青蒿素含量极低,只有万分之几,这也导致在初期实验结果中,青蒿提取物对疟疾的抑制率非常低。正是屠呦呦慧眼识珠,经过毒性、植物资源等方面综合因素权衡,采用低温提取这种科学方法,在提取青蒿素有效成分中才能获得突破。她从东晋葛洪(公元283-343年《)肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”的记载中受到启发,开始着手对提取方法进行改进。提出改用乙醚低温提取后,将青蒿提取物分为中性、酸性2个部分。经过多达384次的反复试验,终于在1971年10月4日,发现分离获得的第191号样品显示出对鼠疟原虫有100%抑制率的惊人结果,并在猴疟上重复结果一致。改用乙醚低温提取青蒿素,这一科学方法的正确运用,是当时发现青蒿粗提物有效性的关键,也算真正从传统中草药植物青蒿中,首次分离得到了具有抗疟有效成分的青蒿素粗提物。
另外,屠呦呦还是最早开始采用科学方法,对青蒿素进行纯化、临床试验及参与化学结构测定等多个重要环节的关键研究人员之一。在临床试验过程中,屠呦呦带头试服,观察毒性,而且亲自携药去海南昌江疟区现场,验证间日疟11例,恶性疟9例,混合感染l例,结果病人用药后,40℃高烧很快降至正常,疟原虫大幅度杀灭至转阴,疗效明显优于氯喹。1971年又在北京302医院验证9例,均取得很好的疗效。1972年11月17日,在北京召开的全国“523”大会上,屠呦呦首次报告了30例青蒿抗疟全部有效的疗效总结。随后,中国中医研究院抗疟科研组在得到有效单体后,立即着手青蒿素的化学结构鉴定研究。首先进行了常规的元素分析,在1973年确定青蒿素为倍半萜内酯类化合物后,开始寻找有关单位协作。先后从中分离得到包括青蒿素在内的17个化合物,其中6个为自然界较为少见的结构独特的含氧倍半萜类的新化合物(其中包含青蒿甲素和青蒿乙素),极大带动了青蒿素衍生物的研究进度。
在青蒿素的发现史上,协同创新是个主旋律。自1964年起,中国就在军内开展抗疟研究。初期参与疟疾治疗的科研单位包括中国人民解放军军事医学科学院、第二军医大学,以及广州、昆明和南京军区所属的军事医学研究所。但仅凭军队力量很难在短时间内解决抗药性恶性疟疾的防治问题,所以,由中国人民解放军总后勤部出面,商请中华人民共和国科学技术委员会共同组织军队内外有关单位开展大协作,继续研制新结构类型防治药物。1967年5月4日,经讨论和有关领导部门审定后,由国家科委向有关单位下发了“召开疟疾防治药物研究大协作会议”的通知。5月18日,在北京举行了“全国疟疾防治研究领导小组会议”。5月23日,国家科委、解放军总后勤部在北京饭店正式召开了“疟疾防治药物研究工作协作会议”,由国家部委、军队直属和有关省、市、自治区的数十个单位组成了攻关协作组,简称“523办公室”或“523领导小组”,简称“523任务”。1978年11月23—29日,全国“523办公室”领导小组在江苏省扬州市主持召开了青蒿素(黄蒿素)治疗疟疾科研成果鉴定会。由承担青蒿素研究任务的相关45个主要单位提交了12个专题,分别由14名专家代表予以报告,由于所报告的内容是根据参与协作的各单位的资料汇总,因此报告的内容并非仅限于个人成果。
青蒿素的发现历程,曾有人形象地比喻这是一场“接力棒”比赛。从1964年开始寻找治疗疟疾的方法,到1967年“523任务”正式立项,至1980年结束任务,经过长达16年的艰苦奋战,由中国数百名科学家经过坚持不懈的多年深入研究最终发现了青蒿素。时至今日,青蒿素的故事还在继续,这种“协同创新”的模式还在不断复制。许多科研人员在青蒿素人工合成领域不断取得重要进展,已开发研制出很多青蒿素衍生物。蒿甲醚属中国科学院上海药物研究所等首创;青蒿琥酯属桂林制药厂等首创;蒿甲醚-本芴醇复方由军事医学科学院首创。上述单位的合作层次,既有国家目标下的大集团作战,也有科学共同体内的交流,还包括了国内外的合作与交流。随着越来越多新兴研究力量的加入,青蒿素研究也成为继承发扬集体主义精神的成功范例。
以上分析表明,青蒿素发现所取得的成功非常重要,屠呦呦获诺奖是对中国世界级贡献的认可。从中可以得到3点重要科学启示:
1)结合科学史上棉酚、常山的案例,可以意识到科学研究并不是一帆风顺的,有时候其中潜在的科研风险往往是巨大的,投入了很多的精力、投入了很多的经费,可是最后这些项目也许还会下马,从中可以清晰地折射出无法预见的科研风险。
2)在屠呦呦获奖的光环下,面对中医药有效成分的提取问题,许多人都在期盼以此为思路取得获得更大的成就,并希冀继续获奖。然而,要清醒地意识到,在用科学方法提炼得到中草药的有效成分过程中,对植物草药中有效成分的提取与中医是两回事。前者是是用现代科学方法做到精益求精,按照现代科学的评价标准来完成的,后者则多是采取传统的煎煮方式简单地进行中草药的熬制。
3)当今要想获得重大科学成就,需要团队合作来攻关。从许多超大型项目的科研模式来看,一项科研成功的取得需要很多人一起参与、共同努力才能实现,屠呦呦的获奖是站在无数参与者的肩膀上完成这一历史飞跃的,她较早地通过科学方法提取到青蒿素粗提物、并采用不同的科学方法对青蒿素进行纯化、临床试验及参与化学结构测定,并首先公开发表论文,都是其获得诺奖的重要因素之一。但是,我们不能忘记,也无法抹去“523任务”背后的众多默默无闻、无私奉献的群体和个人,最后谨向“523”这个光荣的集体再次致以崇高的敬意!
以上思考表明,应认真反思屠呦呦获奖背后的科研模式,在科研过程中,要防止狂热地一哄而上将传统中医药文献作为科研重点,同时,需要清醒地意识到用科学方法对中医药领域的有效成分加以提炼和化学分析,才是一条通往成功的正确之路。